REPORTE DE CASO
Síndrome hipereosinofílico
con eritrodermia
Hypereosinophilic syndrome with erythrodermia
Héctor Huayhua-Guevara 1,
Miguel A.Vargas-Cruz 2 y
César A. Chian-García 3
https://doi.org/10.36393/spmi.v33i1.507
/
1.
Médico
residente de Nefrología. Facultad de Medicina, Universidad Nacional Mayor de
San Marcos. Hospital Nacional Arzobispo Loayza.
2.
Médico
internista. Facultad de Medicina, Universidad Nacional Mayor de San Marcos.
Hospital Nacional Arzobispo Loayza.
3.
Médico
patólogo. Facultad de Medicina, Universidad Peruana Cayetano Heredia. Hospital
Nacional Arzobispo Loayza.
RESUMEN
Varón de 77 años de edad, con antecedentes de insuficiencia cardiaca y
fibrilación auricular recibiendo warfarina,
hipotiroidismo, diabetes mellitus e hiperuricemia, con historia de un año de
lesiones dérmicas eritematosas y descamativas en el
tronco, pruriginosas y con moderada eosinofilia
recurrente. Después de descartarse causas alérgicas, parasitarias, autoinmunes
y neoplásicas, se hizo el diagnóstico de síndrome hipereosinofílico
idiopático. Recibió tratamiento con prednisona e hidroxiurea, consiguiéndose una remisión completa de la eosinofilia y mejoría progresiva de las lesiones dérmicas.
Palabras claves: Eosinofilia, hipereosinofilia, piel, prednisona.
ABSTRACT
A 77-year-old male, with a history of heart failure and atrial fibrillation receiving warfarin, hypothyroidism, diabetes mellitus and hyperuricaemia,with a one-year history of erythematous and desquamative skin lesions in the trunk, pruritic and moderate recurrent eosinophilia. After allergic, parasitic, autoimmune and neoplastic causes were ruled out, the diagnosis of idiopathic hypereosinophilic syndrome was done. He was treated with prednisone and hydroxyurea, resulting in complete remission of eosinophilia and progressive improvement of dermal lesions.
Keywords: Eosinophilia, hypereosinophilia, skin, prednisone.
INTRODUCCIÓN
El síndrome hipereosinofílico (SH) es una
enfermedad caracterizado por eosinofilia >1 500
células/µL, persistente, documentada en dos ocasiones por espacio de un mes y/o
confirmación patológica de hipereosinofilia tisular,
evidencia de daño o disfunción de órgano mediada por eosinófilos
y exclusión de otras causas potenciales que podrían explicar dicha eosinofilia. (1)
El SH es raro, se desconoce la prevalencia real, estimándose 0,36-6,3
por cada 100 000 habitantes en Estados Unidos. (2)
La mayoría de los pacientes se diagnostican a la edad de los 20 a 50 años,
pero en niños también pueden presentarse y la forma frecuente es primaria clonal tipo mieloide. (3,4)
En nuestro país son escasos los reportes de esta entidad. Presentamos el
caso de un paciente con prurito persistente y eritrodermia,
con eosinofilia moderada y recurrente, iniciando el
abordaje clínico con el estudio diferencial de eosinofilia.
PRESENTACIÓN DEL CASO
Paciente varón de 77 años, procedente de Yunguyo-Puno
con antecedente de haber trabajado 12 años en una mina a partir de los 20 años
de edad, con antecedentes de falla cardiaca crónica de hace 20 años y
fibrilación auricular de hace 15 años en terapia con warfarina;
hipotiroidismo de hace 15 años; diabetes mellitus sin tratamiento más
hiperuricemia; operado de varices en la pierna derecha hace 30 años y de hernia
umbilical hace 10 años. Realizó un viaje a Brasil (Porto Alegre) un año atrás
por espacio de tres meses.
Ingresó con un tiempo de enfermedad de un año que inició con prurito en
las manos de manera intermitente, que se extendió a los brazos y el rostro, de
intensidad moderada por lo que acudió a un consultorio privado de dermatología
donde le prescribieron cremas sin mejoría significativa. Hace seis meses, el
prurito se generalizó con predominio del dorso. Hace dos meses notó edema y
eritema en la cara por lo que fue hospitalizado por dos semanas, recibiendo un
curso de prednisona 50 mg/día y al alta con 20 mg/
día, mejorando el prurito pero, parcialmente, las lesiones dérmicas.
Quince días antes de su ingreso a nuestro hospital, reinició el prurito
generalizado y disnea de esfuerzos a 100 y 200 metros) y ortopnea
leve por lo que acudió a consultorio externo de oncología quienes indicaron su
hospitalización. El examen físico de ingreso: lúcido, piel difusamente
acartonada, hiperpigmentada, gruesa con lesiones
eritematosas y descamativas generalizadas, liquenificadas (Figuras 1 y 2). Edema duro y frío de los
miembros inferiores que dejan fóvea. Macroglosia y en
el cuello se palpaba una adenopatía submandibular
derecha de 1 x 2 cm, indurada y móvil. Aparato cardiovascular: ruidos cardiacos
arrítmicos, de regular intensidad y frecuencia normal con pulso deficitario, no
soplos. Tórax y pulmones: murmullo vesicular normal, no ruidos agregados.
Abdomen globuloso, timpánico, blando, depresible, no doloroso,
no visceromegalia. Neurológico: orientado en tiempo,
espacio y persona, no déficit motor ni sensitivo, no signos meníngeos ni de
focalización.
Exámenes previos al ingreso. Radiografía de tórax: cardiomegalia global,
ICT de 0,6. TAC abdominal y pélvica: pequeños quistes en el riñón izquierdo.
Biopsia de piel (tres meses antes del ingreso): dermatitis crónica espongiótica con numerosos eosinófilos,
sin linfocitos intraepidérmicos ni atípicos,
concluyendo como eccema crónico. Biopsia de ganglio inguinal (una semana antes
del ingreso): abundantes linfocitos, algunos de ellos atípicos, no concluyente.
Biopsia de piel (una semana ante del ingreso): dermis con moderado infiltrado
de linfocitos pequeños y moderada cantidad de eosinófilos,
hasta 25 por campo, sugerente de reacción adversa a medicamentos u otro agente
alérgico.
En los hemogramas previos a su ingreso se evidenció eosinofilia
persistente (Cuadro 1). En los exámenes auxiliares de ingreso a nuestro
hospital: Hb 13,20 g/dl, leucocitos 12 200/mm3 (abastonados 4%, neutrófilos 36%, eosinófilos
32%, linfocitos 20%, monocitos 8%), plaquetas 304 000 /mm3; bioquímica
sanguínea normal. TSH 1,75 UI/ml, T4 libre 0,86 ng/dl.
PCR 16,49 mg/dl, VSG 45 mm/hora. Calcio 8,3 mg/dl, DHL 498 U/l. INR 1,79 (con
anticoagulación), TP 19,4 seg.
Estudios serológicos: VHB, VHC, VEB, VIH, HTLV I-II, brucella,
tíficos y paratíficos, todos negativos
Examen parasitológico seriado: negativos. FAST 2 Fasciola
(anticuerpos) 0,09 (no infección). IgE>2 500
UI/ml. Anticuerpos contra Toxocara canis (IgM) 0,1 (negativo).
Biopsia de piel: Epidermis con paraqueratosis,
hiperplasia psoariasiforme irregular y espongiosis; en dermis, marcado infiltrado eosinófilo perivascular e
intersticial que llega hasta el tejido celular subcutáneo acompañado de
infiltrado mononuclear (Figuras 3 y 4).
Biopsia de ganglio cervical: ganglio linfático infiltrado por sábanas de
histiocitos epitelioides con depósitos de pigmento
más algunos eosinófilos y numerosas células
plasmáticas, hallazgos compatibles con linfadenopatía
dermatopática (Figuras 5 y 6)..
Citometría de flujo (Aspirado de médula ósea): células neoplásicas 0%, blastos 1,14%, neutrófilos 65,01%, monocitos 3,49%,
basófilos 0,15 %, eosinófilos10,04%, linfocitos T
4,97%, CD4/CD8 0,95, linfocitos B 0,22%, kappa/lambda 1,37%, progenitores B
0,15%, NK 1,14%, linfocitos TCR g/d 0,31%, plasmocitos 0,47 %, eritroide 12,91%.
Estudio genético para la aberración del gen FIP1L1/ PDGFRA mediante el
método molecular RT-PCR convencional: negativo.
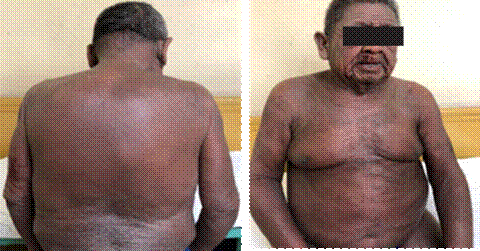
Figuras 1 y 2. Eritrodermia y síndrome hipereosinofílico.
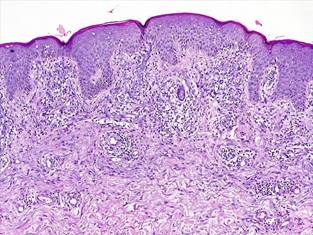
Figura 3. Biopsia de Piel. HE10X. Se observa hiperplasia epidérmica
irregular e infiltrado inflamatorio perivascular superficial.
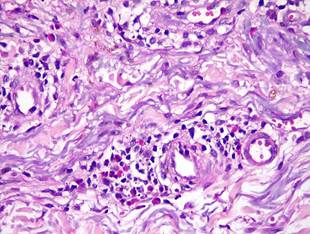
Figura 4. Biopsia de Piel. HE40X. Se observa infiltrado dérmico con
numerosos eosinófilos.
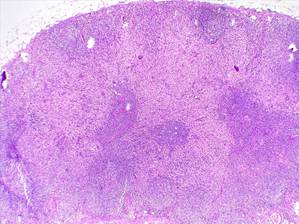
Figura 5. Biopsia de Ganglio. HE10X. Se observa marcada expansión
sinusoidal (áreas de tonalidad pálida que ocupan la mayor parte del tejido) con
pequeño remanente de folículos linfoides primarios (áreas más oscuras).
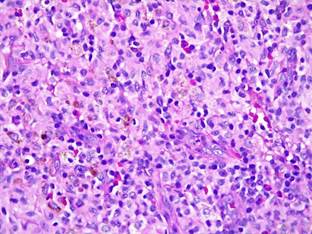
Figura 6. Biopsia de Ganglio. HE40X. Se observa numerosos histiocitos
(células de citoplasma amplio y claro), eosinófilos y
depósitos de pigmento marrón, de apariencia melánica.
Con el diagnóstico de SH se inició terapia con corticoide (prednisona 1 mg/k/d) e hidroxiúrea
(10 mg/k/d), presentando mejoría clínica y remisión completa de la eosinofilia (ausencia de eosinófilos)
en un periodo menor a 5 días. Al mes, el compromiso dérmico presentó gran
mejoría sin descamación y disminución notable del engrosamiento dérmico, así
como la desaparición del prurito.
DISCUSIÓN
El proceso de diagnóstico de un paciente con eosinofilia
empieza por confirmar la certeza del aumento de los eosinófilos,
valorar el recuento absoluto de los mismos para clasificarlos según su
severidad en leve (500-1 500), moderado (1 500-5 000) y severo (>5 000), así
como el contexto epidemiológico y clínico. Cuadro 2.
Iniciamos un enfoque diagnóstico de causas asociadas a eosinofilia. Entre los diagnósticos principales a tenerse
en cuenta teníamos la etiología neoplásica y la secundaria a parasitosis por el
antecedente epidemiológico de provenir de una zona endémica de fasciolasis, la región de Yunguyo.
(7,8)
Nuestro paciente se presentó con prurito que se reporta de manera
frecuente en el SH pero la eritrodermia generalizada
es menos usual. (9) Los estudios parasitarios fueron negativos y las biopsias
dérmicas sugerían reacción a medicamentos y linfadenopatía
dermatopática. La citometría
de flujo alejó la sospecha de neoplasias sistémicas o de localización dérmica.
(10,11,12) Se le retiró todos los medicamentos, los
síntomas persistieron y empeoraron haciendo menos probable la causa
medicamentosa pero no descartada totalmente debido a que paciente recibía warfarina por un largo periodo y el cual podría asociarse a
eosinofilia y a SH ya sea de manera inmediata, días e
incluso meses después de haber tomado dicho medicamento; además, la remisión de
la eosinofilia medicamentosa puede durar semanas a
meses. (13,14)
|
Cuadro 1. Conteo de eosinófilos del paciente
durante la evolución de enfermedad. |
||||||||||
|
N° de días * |
-301 |
-116 |
-83 |
-73 |
-38 |
-30 |
-10 |
0 |
+8 |
+9 |
|
Hb (g/dl) |
14,1 |
16,2 |
16,6 |
15,2 |
16,9 |
15,8 |
13,3 |
13,2 |
14,0 |
13,9 |
|
Leucocitos/mm3 |
11 690 |
11 750 |
5 480 |
10 800 |
9 860 |
13 340 |
11 980 |
12 200 |
10 970 |
16 370 |
|
% eosinófilos |
24 |
27 |
0 |
6 |
20 |
20 |
25 |
32 |
0 |
0 |
|
N° de eosinófilos/mm3 |
2 805 |
3 172 |
0 |
648 |
1 972 |
2 668 |
2 995 |
3 904 |
0 |
0 |
Número de días respecto del día de ingreso (0).
|
Cuadro 2: Causas de eosinofilia según
severidad |
|||
|
Etiología /
severidad |
Leve |
Moderado |
Severo |
|
Infeccioso |
Enfermedades
parasitarias |
Enfermedades
parasitarias, fasciolasis |
Toxocara cani o cati, áscaris, trichina, estrongilodiasis |
|
Alergias |
Rinitis alérgica,
Atopia, asma extrínseca, enfermedades dérmicas, Enfs.
pulmonares ocupacionales |
Asma intrínseca |
|
|
Medicamentos |
Reacción a drogas |
Reacción a drogas |
Reacción a drogas |
|
Hematlógicos Neoplásicos |
Síndromes mieloproliferativos |
Síndromes mieloproliferativos, mastocitosis |
Leucemia eosinofílica |
|
Inmunológicas |
Estado de
inmunodeficiencia |
Poliarteritis nodosa |
Poliarteritis nodosa |
|
Otros |
Diálisis de largo
tiempo, radioterapia |
Síndrome hipereosinofílico |
Síndrome hipereosinofílico |
Adaptado de las ref.10
En cuanto a alergias y enfermedades autoinmunes, el paciente no tenía
antecedente ni historial clínico compatible con atopias, rinitis, asma, ni
estigmas de enfermedad autoinmune. Se procedió luego a descartar linfoma
cutáneo de células T así como síndrome de Sézary,
realizándose nueva biopsia de piel que concluyeron como negativos a neoplasia.
La citometría de aspirado de médula ósea estudio y el
genético en busca de la aberración del gen FIP1L1/ PDGFRA descartaron toda
posibilidad de neoplasia (15, 16).
Habiéndose descartado la mayoría de etiologías asociadas se catalogó
como SH con compromiso dérmico, confirmado por la biopsia de piel.
Se hizo diagnóstico de SH en base a los siguientes criterios: hipereosinofilia (eosinófilos
>1 500 células/mm3) persistente y documentada en dos ocasiones por espacio
de un mes, confirmación patológica de hipereosinofilia
tisular, evidencia de daño o disfunción de órgano mediado por eosinófilos y exclusión de otras causas potenciales que
podrían explicar dicha eosinofilia. (1)
El SH es una entidad poco frecuente que puede tomar una evolución desde autolimitada en la mayoría de los casos o ser muy severa y
progresiva con infiltración de órganos conllevando a una alta mortalidad. La
patogénesis abarca desde la clonalidad a nivel de
células precursoras hematopoyéticas hasta presentar una respuesta cíclica
persistente que hacen perdurar y aumentar la sobrevida y acción de los eosinófilos mediado por IL-5, IL-1, IL-3, IL-4, FNT-alfa,
células T, citoquinas, quimiocinas, leucotrienos y mastocitos.
La clasificación está basada en tres grandes grupos:(10,15,16)
-Primaria: la alteración es clonal a nivel
medular en la célula madre, que en la mayoría se han detectado aberraciones
cromosómicas y la más frecuente se encuentra a nivel de cromosoma 4q12 donde se
presenta la fusión de dos genes: FIP1L1 (Fip1-Like1) y PDGFR alfa (platelet-derived growth factor
receptor alpha) de importancia clínica ya que esta
entidad responde a inhibidores de tirosin-kinasa como
imatinib.
-Secundaria: la alteración por respuesta de un agente infeccioso,
neoplásico, fármacos, alérgico que causa compromiso eosinofílico
y que perpetúa la respuesta inflamatoria disminuyendo la apoptosis y aumentado
las citosinas y otros factores inflamatorios y proinflamatorios.
-Idiopática: a pesar de los estudios y descartando la patología
primarias y secundarias no se llega a filiar la etiología quedando como SH
idiopático.
Ciertas variantes de SH (aquellas asociadas con las aberraciones en el
gen de los receptores alfa y beta del factor de crecimiento derivado de las
plaquetas (PDGFRA, PDGFRB) ocurren casi exclusivamente en los hombres, mientras
que otras como SH-L (variante linfocítica) y SH de etiología desconocida
parecen estar distribuidos equitativamente en ambos sexos. (5,6) Las
manifestaciones clínicas son variables y dependen del órgano afectado, y las
más frecuentes son las manifestaciones cutáneas: (11,17). Cuadro 3.
El compromiso cardíaco es la principal causa de morbilidad y en décadas
pasadas de mortalidad del SH. Se presenta con una frecuencia alrededor del 50%
de los pacientes con este síndrome. El riesgo de desarrollar enfermedad
cardíaca no se relaciona con la magnitud ni con la duración de la eosinofilia. Se presenta con mayor frecuencia en pacientes
de sexo masculino, con un fenotipo HLA-Bw44, que presentan esplenomegalia,
trombocitopenia, incremento en los niveles de vitamina B12, eosinófilos
hipogranulares o vacuolados
y precursores mieloides. El daño cardíaco es variable, pudiendo evolucionar
desde una necrosis temprana a una subsecuente trombosis y fibrosis. Los
hallazgos cardíacos típicos consisten en fibrosis endomiocárdica
y trombosis mural, más frecuente a nivel de las puntas de ambos ventrículos. La
trombosis puede extenderse a los tractos de salida de las válvulas auriculoventriculares, produciendo insuficiencia valvular.
La insuficiencia cardíaca congestiva puede ser el resultado de las anomalías
valvulares o de la fibrosis endomiocárdica o de
ambas. Los pacientes con SH con compromiso cardíaco suelen presentarse en los
estadios tardíos, trombótico y fibrótico.
Las manifestaciones clínicas incluyen: disnea, dolor torácico,
insuficiencia cardíaca congestiva, insuficiencia mitral y cardiomegalia. El ECG
puede evidenciar arritmias, inversión de ondas T. El ecocardiograma
bidimensional detecta anomalías en el 50% de los pacientes y las alteraciones
varían según el estadio en el que se encuentren los pacientes, no encontrándose
hallazgos patológicos en la fase necrótica. (20)
Nuestro paciente tenía fibrilación auricular e insuficiencia cardiaca
congestiva que podrían ser explicables por las comorbilidades que presentaba:
diabetes Mellitus de larga evolución, falla cardiaca previa como manifestación
de cardiopatía isquémica o por cardioangioesclerosis.
En este contexto no se podría descartar la posibilidad de infiltración cardiaca
por eosinófilos como parte del SH teniendo en cuenta
la frecuente afectación del corazón en este síndrome. Esto último requería de
una biopsia cardiaca pero no era práctico para el manejo del paciente.
Nuestro paciente con diagnóstico de síndorme hipereosinofílico idiopático con compromiso dérmico fue
tratado con prednisona e hidroxiurea,
consiguiéndose una remisión completa de la eosinofilia,
así como mejoría progresiva de las lesiones dérmicas durante el primer mes de
tratamiento.
|
Cuadro 3. Síndrome hipereosinofílico.
Manifestaciones clínicas |
||||
|
Manifestación
clínica |
|
ESTUDIOS (%) |
|
Descripción |
|
|
OGBOGU et al 2009 |
RAMOS et al 2005 |
WELLER et al 1994 |
|
|
Dermatológico |
37 |
57 |
56 |
Manifestaciones
Frecuentes: Prurito, urticaria, dermografismo, angioedema,
pápulas, placas y nódulos eritematosos, erupción inespecífica. Manifestación
infrecuentes: Prurito acuagénico, hemorragias, en astillas, púrpura palpable,
decoloración livedoide, síndrome de Wells, eritrodermia, vasculitis eosinofílica,
necrosis acral, petequias, eritema anular
centrífugo, ulceración de las mucuosas y eritema. |
|
Pulmonar |
25 |
40 |
49 |
Asma, sinusitis,
rinitis, tos, disnea, infecciones de tracto respiratorio superior
recurrentes, infiltrado pulmonar, efusión pleural. |
|
Gastrointestinal |
14 |
31 |
23 |
Dolor abdominal,
vómito y diarrea. |
|
Reumatológico |
7.4 |
- |
- |
Artralgia, mialgia,
vómito y diarrea |
|
Cardiológico |
4.8 |
48 |
58 |
Falla cardiaca
congestiva, anmalía valvular, cardiomiopatía,
efusión pericárdica, miocarditis. |
|
Neurológico |
4.8 |
42 |
54 |
Vértigo, parestesia,
alteraciones mentales, afasia, alteraciones visuales. |
|
Constitucional |
5.3 |
- |
- |
Fiebre, pérdida de
peso, malestar, fatiga, resfriado. |
|
Hematológico |
3.2 |
- |
100 |
Anemia, trombosis
venosa profunda, tromboflebitis superficial. |
*Adapted from a
table in Ref. (5,19,)
REFERENCIAS BIBLIOGRÁFICAS
1. Heung R. Hypereosinophilic syndrome. Allergy Asthma Proc.2017;38:78-8.
2.
Crane MM, Chang CM, Kobayashi
MG, Weller PF. Incidence of myeloproliferative hypereosinophilic
syndrome in the United States and an estimate of all hypereosinophilic
syndrome incidence. J Allergy Clin Immunol.
2010; 126: 179-81.
3.
Farruggia P, D’Angelo P, Acquaviva A, Trizzino A, Tucci F, Cilloni D, et al. Hyperosinophilic syndrome in childhood:
Clinical and molecular features of two cases. Pediatr Hematol Oncol.
2009; 26(3): 129-135.
4. Rapanotti MC, Caruso R, Ammatuna E, Zaza S, Trotta L, Divona M, et al. Molecular characterization of paediatric idiopathic hypereosinophilia. Br J Haematol. 2010 Dec; 151(5):440-6. doi: 10.1111/j.1365-2141.2010.08394.x. Epub 2010 Oct 19.
5.
Ogbogu PU, Bochner BS, Butterfield JH, Gleich GJ, Huss- Marp J, Kahn JE, et al. Hypereosinophilic
syndrome: a multicenter, retrospective analysis of clinical characteristics and
response to therapy. J Allergy Clin Immunol.
2009 Dec;124(6):1319-25.e3. doi:
10.1016/j.jaci.2009.09.022.
6.
Cheah CY, Burbury K, Apperley
JF, Huguet F, Pitini V, Gardembas M, et al. Patients with myeloid malignancies
bearing PDGFRB fusion genes achieve durable long-term remissions with imatinib. Blood. 2014 Jun 5;123(23):3574-7.
doi: 10.1182/blood-2014-02-555607.
Epub 2014 Mar 31.
7.
Marcos, LA,
Terashima, A, Leguia, G, Canales,
M, Espinoza, JR, Gotuzzo E. La infección por fasciola hepática en el Perú: una enfermedad emergente. Rev Gastroenterol Peru, 2007;27(4), 389- 396.
8.
José R.
Espinoza JR, Terashima A, Herrera-Velit
P, Marcos LA. Fasciolasis humana y animal en el Perú:
impacto en la economía de las zonas endémicas. Rev Peru Med Exp
Salud Publica. 2010; 27(4): 604-12.
9.
Sundaramurthi VL, Prabhavathy D, Somasundaram
SV, Wahab AJ. Hypereosinophilic
syndrome: cutaneous involvement as the sole manifestation. Indian J Dermatol. 2011 Jan;56(1):107-9. doi:
10.4103/0019-5154.77570.
10.
Brigden ML. A practical workup for eosinophilia. Postgraduate Medicine. 1999;105 (3):193-210, DOI:
10.3810/pgm.1999.03.638
11.
Noh HR, Magpantay
GG. Hypereosinophilic syndrome. Allergy Asthma Proc 2017; 38:78-81.
12.
Hsieh, Fred H. Hypereosinophilic syndrome. Annals of Allergy, Asthma &
Immunology. 2014;112(6):484-488.
13.
Curtis CD, Ogbogu
PU. Evaluation and differential diagnosis of persistent marked eosinophilia. Immunol Allergy Clin North Am. 2015:35(3)387-402.
14.
Hall D, Link K. Eosinophilia
associated with coumadin. N Engl J Med. 1981 Mar 19;304(12):732-3.
15.
Gotlib J.World Health Organization-defined
eosinophilic disorders: 2017 update on diagnosis, risk stratification, and
management. Am J Hematol. 2017 Nov;92(11):1243-1259.
doi: 10.1002/ ajh.24880.
16.
Dispenza MC, Bochner BS. Diagnosis and novel
approaches to the treatment of hypereosinophilic
syndromes. Curr Hematol Malig Rep. 2018;13(3):191-201.
doi:10.1007/s11899-018-0448-8
17. Leiferman KM, Gleich GJ, Peters MS. Dermatologic manifestations of the hypereosinophilic syndromes. Immunol Allergy Clin North Am. 2007 Aug;27(3):415-41.
18.
Kahn JE, Groh M, Lefèvre G. (A critical appraisal of )
Classification of hypereosinophilic disorders. Front Med (Lausanne). 2017 Dec 5;4:216. doi:
10.3389/fmed.2017.00216. eCollection 2017.
19.
Ramos Casal
M, García Carrasco M, Gómez de Salazar J R, Calvo Alen
J, Front Franco J. Enfermedades autoinmunes sistémicas y Reumatológicas.
Madrid: Masson, 2005. Capítulo 46, Fascitis eosinofílica; pp.
619-630.
20.
Mankad R, Bonnichsen
C, Mankad S. Hypereosinophilic syndrome: cardiac
diagnosis and management. Heart. 2016 Jan;102(2):100-6.doi: 10.1136/heartjnl-2015-307959. Epub 2015 Nov 13.
CORRESPONDENCIA:
hectorhuayhuaguevara@gmail.com
Fecha de recepción: 12-01-2020.
Fecha de aceptación: 09-03-2020.
-----------------------------------
Citación
Huayhua-Guevara H, Vargas-Cruz M.A y Chian-García C.A. Síndrome hipereosinofílico con eritrodermia. Rev Soc Peru Med Interna. 2020;33(1):25-30.https://doi.org/10.36393/spmi.v33i1.507 /