INTRODUCCIÓN
La obesidad es una enfermedad crónica,
multifactorial, de características inflamatorias, que aumenta la morbilidad y
mortalidad cuando se asocia a otras enfermedades, tales como diabetes, hipertensión, esteatosis
hepática, dislipidemia, síndrome metabólico. Se presenta en cualquier lugar del
mundo, y en todas las edades, con una prevalencia ligeramente más alta en las
mujeres que en los hombres.1 La ingesta de comidas ricas en carbohidratos y grasas, asociado a poca actividad física,
generan un desbalance entre el aporte y el gasto calórico, que producen un
aumento en el peso corporal por acumulación de tejido graso, afectando el
metabolismo de lípidos y carbohidratos.2 El contenido y la distribución de la
grasa corporal total son rasgos sexualmente dimórficos. Las mujeres tienen un
mayor contenido de grasa corporal que los hombres, especialmente en la región
glúteo-femoral (obesidad ginecoide). Los hombres presentan mayor masa muscular
y la acumulación de grasa es más abdominal y visceral (obesidad androide), que
a su vez son los más nocivos para la salud. Con la menopausia las mujeres
comienzan a acumular grasa en el
compartimiento visceral, con lo
que aumenta su riesgo de morbilidad y mortalidad a enfermedades crónicas no
transmisibles.3
Si bien una de las estrategias que se
ha desarrollado en las últimas décadas para reducción de peso es la cirugía
bariátrica, los hombres representan una minoría entre los pacientes que se
someten a este tipo de cirugía. Generalmente tienen un índice de masa corporal
(IMC) más alto y con mayores comorbilidades que las mujeres. El beneficio del
procedimiento es igual en ambos sexos, aunque la satisfacción es mayor en los
hombres, necesitándose más estudios sobre los aspectos específicos del sexo en
el resultado de la cirugía bariátrica, especialmente en lo que respecta a los
aspectos metabólicos.4 La presente es una revisión narrativa donde se intenta
analizar cómo es que la cirugía bariátrica produce reducción de peso afectando
el metabolismo de los lípidos y carbohidratos. Para ello se revisó la
literatura de los últimos cinco años donde se aborda la asociación de la
cirugía bariátrica con la microbiota intestinal, y si tiene un rol importante
en el metabolismo calórico-proteico del hospedero.
MICROBIOTA
INTESTINAL
La microbiota intestinal es la
población microbiana que vive en el intestino de manera comensal y mutualística
con el hospedero. Está compuesto principalmente por bacterias, además de
arqueas, hongos y virus.5 El término microbioma se refiere al número total de
microorganismos y su material genético, referido no solo a la cantidad y
composición, sino también a los metabolitos que producen y a las funciones que
ejercen en el medio intestinal.6
El microbioma humano ha ido
evolucionando con los seres y a lo largo del tiempo, desarrollándose
comunidades microbianas específicas en lugares anatómicos específicos en el cuerpo.7
La colonización con organismos comensales comienza en el feto por una
transmisión vertical de la madre demostrado por la presencia de microorganismos
en la placenta, en el líquido amniótico, en la sangre del cordón umbilical y en
el meconio; después, con el nacimiento, de acuerdo al tipo de parto, por la
exposición a la microbiota vaginal.8 A partir de ese momento, factores del
medio ambiente, como la dieta y la interrelación con
otros seres humanos, van
definiendo el perfil de la microbiota, alcanzando su máxima diversidad en la
adolescencia, manteniéndose estable hasta las últimas etapas de la vida. Varios
aspectos de la vida, como el uso de antibióticos, las infecciones y la
estructura de la dieta producen cambios profundos y duraderos sobre el
microbioma humano. 9-11 La microbiota intestinal de cada ser humano es única y
es considerada como una “huella digital”.
Se calcula que la cantidad de
bacterias en el intestino es, como mínimo, igual a la cantidad de células
humanas en el cuerpo (proporción 1:1), con una presencia genómica 100 veces
mayor.12 La mayor proporción son bacterias que se encuentran en el colon,
distribuidas en los filos Firmicutes y Bacteroidetes, que son la mayoría,
además de los filos Proteobacteria, Actinobacteria, Fusobacteria y
Verrucomicrobia.13,14 Las funciones centrales de la microbiota intestinal
saludable incluyen la biodegradación de polisacáridos, la producción de ácidos
grasos de cadena corta, el enriquecimiento de lipopolisacáridos específicos y
la producción de vitaminas y aminoácidos esenciales.15 (Tabla 1).
Tabla 1 Metabolitos producidos por la
microbiota intestinal.
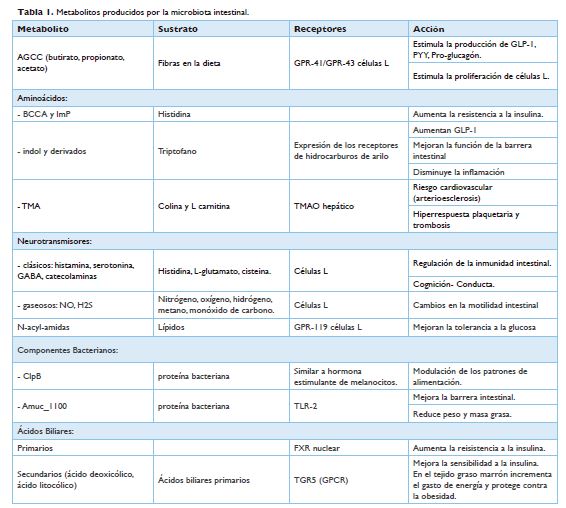
AGCC:
ácido graso cadena corta. BCCA: aminoácido esencial ramificado. ImP: propionato
de Imidazol. TMA: trimetilamina. TMAO: óxido de trimetilamina. GABA: ácido
gamaaminobutírico. NO:
óxido
nítrico. H2S: ácido sulfíhidrico. Receptores: GPR, TGR, AhR, TLR, FXR. Adaptado
de Rastelli et al 2019.
DISBIOSIS
La variación interindividual hace
difícil definir una única microbiota saludable.6 El retorno a una conformación
microbiana previa a la enfermedad podría estar relacionado a la recuperación de la salud
(resiliencia bacteriana).16 Cuando
se altera la microbiota intestinal ocurre una disbiosis. La disbiosis es
la incapacidad de
retornar a un estado de microbiota saludable y está asociada a la
disminución de la diversidad bacteriana, inflamación y aumento de la permeabilidad intestinal, lo que a su vez
impacta negativamente sobre la microbiota, alterando la absorción de nutrientes y el metabolismo energético.17
Los sujetos obesos tienen una
microbiota intestinal disbiótica.18 La obesidad materna durante el embarazo es acompañada
por disbiosis intestinal que se transmite en forma vertical al feto,
induciéndole disbiosis intestinal y desórdenes metabólicos.19 Estos cambios
tienen relación con el proceso inflamatorio de bajo grado producido por el
aumento del peso, en especial del compartimiento graso (lipotoxicidad), y se asocia a resistencia a la insulina y, en casos graves, a síndrome metabólico
y esteatosis hepática no alcohólica.20
En general, la disbiosis asociada a la
obesidad se caracteriza, a nivel de filo, por un aumento de Firmicutes y una
disminución de Bacteroidetes, aunque en la actualidad se reconoce que el
reacomodo de las comunidades bacterianas para producir el mismo efecto
metabólico varía de individuo en individuo.21 Asimismo, en los sujetos obesos,
la abundancia relativa de la familia Christensenellaceae y los géneros
Methanobacteriales, Lactobacillus, Bifidobacteria y Akkermansia, todos ellos
usados como probióticos, se asocian inversamente con obesidad.17 La microbiota
intestinal modula la obesidad por la regulación de la absorción de energía de
los alimentos, del apetito central, de los depósitos grasos, de la inflamación
crónica y del ritmo circadiano.17 (Tabla 2).
MICROBIOTA
INTESTINAL Y TRATAMIENTO ANTI- OBESIDAD
La
modificación en la microbiota intestinal que producen los tratamientos de la
obesidad, tanto el tratamiento clínico como el quirúrgico, señalizan vías
metabólicas beneficiosas en el control del peso y las enfermedades asociadas.22
El tratamiento clínico de la obesidad consiste en cambios de estilo de vida
(dietas y actividad física) y/o uso de fármacos que han conseguido buenos
resultados a corto plazo.23
Cirugía
bariátrica
El tratamiento quirúrgico, conocido
como cirugía bariátrica, se ha convertido en una opción terapéutica con buenos
resultados a largo plazo, tanto en el control del peso como de las enfermedades
asociadas, disminuyendo la morbimortalidad y mejorando la calidad de vida.24 La
cirugía bariátrica consiste en la reducción del estómago, asociado o no, a una
alteración de la anatomía del intestino proximal denominado bypass. La técnica
patrón de oro es el bypass gástrico en Y de Roux (BG), aunque hoy en día la
técnica que más se hace en el mundo es la manga gástrica o gastrectomía tipo
Sleeve (MG).25 (Tabla 3).
La cirugía bariátrica produce un
re-arreglo de la anatomía gastrointestinal que provoca la disminución de la
ingesta de alimentos y altera la producción de entero hormonas.26 Estos efectos
son mediados por la microbiota intestinal27 y las sales biliares.28 Las
modificaciones de cada uno de estos factores provoca, a su vez, cambios
metabólicos que van a afectar al huésped.29
Cirugía barátrica y cambios en la microbiota intestinal
Los trabajos de los últimos cinco años
sobre el tema, se caracterizaron por tener muestras pequeñas, la mayoría no
aleatorias, y con un tiempo de seguimiento no mayor a un año.30-54 En los
resultados se aprecia que después de
la cirugía bariátrica hubo
cambios importantes de la
microbiota intestinal, la mayoría similares en ambas técnicas (BG y MG).
A nivel de filo aumentaron
Fusobacteria, Proteobacteria y Verrucomicrobiota; y disminuyó Firmicutes. A nivel de Clase aumentaron Bacilli
y Gammaproteobacteria. A nivel de
Orden aumentó Lactobacillales. A nivel de Familia aumentaron
Enterobacteriaceae, Rikenelliaceae y Streptococcaceae, y
disminuyeron Bacteroidaceae y
Bifidobacteriaceae. A nivel de Género aumentaron Actinomyces, Aggregatibacter,
Akkermansia, Alistipis, Anaerotroncus, Clostridium, Granulicatella,
Haemophylus, Klebsiella, Lachnospiaceae sp., Odoribacter, Prevotella, Rothia,
Ruminococcus, Streptococcus y Veillonella; y disminuyeron Bifidobacterium y Coprococcus.
A nivel de Especies aumentaron Akkermansia muciniphila, Alistipes finegoldi,
Haemophilus parainfluenzae, Streptococcus parasanguinis y Streptococcus
salivarius; y disminuyó Bacteroides stercoris (Tabla 4).
Tablas
2. Mecanismos de obesidad inducidos por la microbiota intestinal
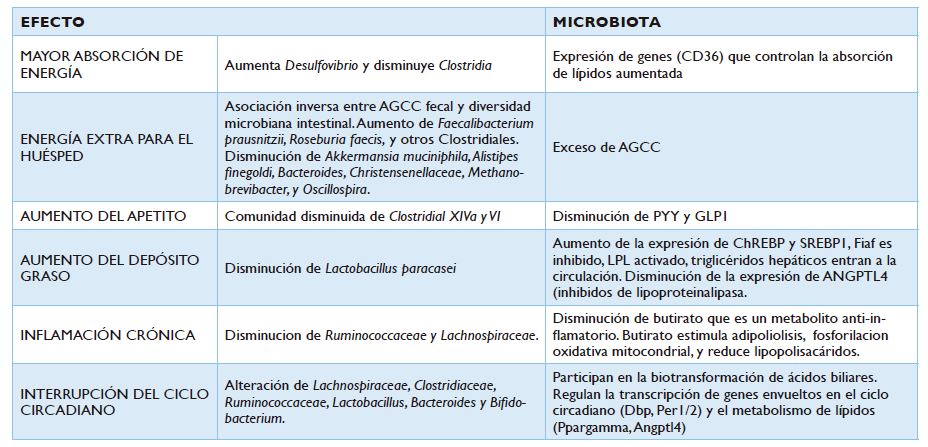
Adaptado
de Liu BN et al 2021.
Tabla
3. Características por tipo de cirugía bariátrica.
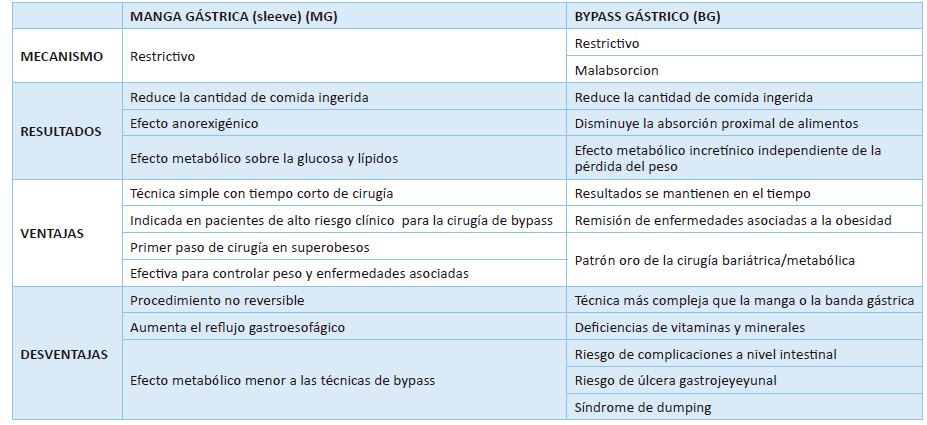
Adaptado
de American Society for Metabolic and Bariatric Surgery (ASMBS)
Tabla
4. Cambios de la microbiota intestinal después de la cirugía (BG y MG).
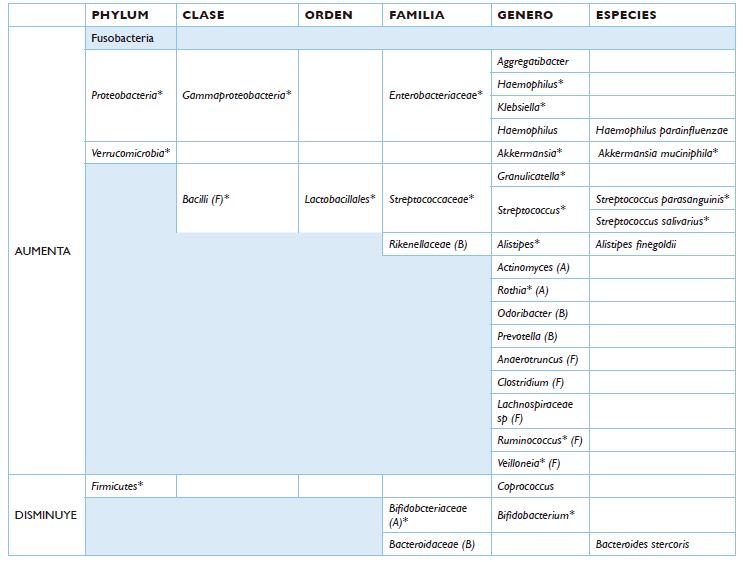
(*)
Bacterias más mencionadas en los estudios. F: firmicutes, B: bacteroidetes, A:
actinobacteria, P: proteobacteria, F: fusobacteria,V: verrucomicrobia.
Tabla
5. Cambios adicionales de la microbiota intestinal por tipo de cirugía.
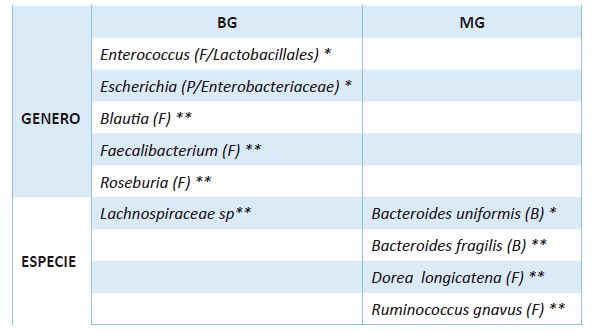
(*):
aumenta (**) disminuye; F: firmicutes, P: proteobacteria, A: actinobacteria, B:
bacteroidetes.
Hay alteraciones específicas de
acuerdo al tipo de cirugía. En el BG aumentaron los géneros Enterococcus y
Escherichia, y disminuyeron los géneros Blautia, Faecalibacterium y Roseburia,
y la especie Lachnospiraceae spp. En la MG aumentó la especie Bacteroides
uniformis, y disminuyeron las especies Bacteroides fragilis, Dorea longicatena
y Ruminococcus gnavus. (Tabla 5)
La diversidad microbiana disminuye
después de la cirugía bariátrica y comienza a aumentar a partir del tercer mes
post quirúrgico, manteniéndose estable en el tiempo de estudio de la mayoría de
los trabajos.30-35,37,40-42,44,46,49-51,53,54 En los primeros meses después de
la cirugía, quizás por tratarse de un periodo de adaptación a los cambios
anatómicos y fisiológicos, hay menos
cantidad de nutrientes y con diferente composición (menos carbohidratos y
grasas), lo que hace que prevalezcan microbiotas más preparadas para extraer
energía de alimentos no digeridos en momentos de gran restricción calórica,
como las Enterobacteriaceae (Proteobacteria).33,34,40
Stefura y col. encontraron que los
sujetos que consiguieron perder 50% o más del exceso de peso a los seis meses
de la cirugía, tuvieron en la microbiota basal preoperatoria abundancia de Epsilonproteobacteria (Proteobacteria), y los que no lo consiguieron tuvieron
abundancia de Rikenellaceae (Bacteroidetes) y Lachnospiraceae (Firmicutes).55
En un trabajo posterior56, al igual que Ilhan y col.57, encontraron que el
perfil de la microbiota intestinal seis meses después de la cirugía, era
distinto en los sujetos que consiguieron perder peso comparado con los que no
lo consiguieron, pero con presencia de géneros y especies diferentes. Pajecki y
col. encontraron que el paciente con la peor pérdida del exceso de peso
(50.79%) a los seis meses de la cirugía, tuvo disminución de Bacteroidetes y
aumento de Firmicutes, perfil parecido al de la obesidad.36
Estos resultados pueden servir de guía
para la selección de pacientes que van a ser sometidos a cirugía bariátrica con
la finalidad de mejorar la tasa de éxito; sin embargo, queda aún por dilucidar
qué se debe hacer en los casos que el perfil de la microbiota no sea adecuado
para una cirugía bariátrica efectiva.
Efectos metabólicos
de los cambios de la microbiota intestinal sobre el huésped
Las alteraciones del pH intraluminal,
por la modificación del estómago y el uso de inhibidores de bomba de protones,
y la cantidad de oxígeno que llega al intestino terminal, son más pronunciados
en el BG que en la MG. Este medio puede favorecer la presencia de bacterias
orales anaerobias facultativas, ácidos sensibles, bilio-resistentes, como
Fusobacteria, Granulicatella, Odoribacter, Streptococcus y Veillonella. Por
otro lado, puede inhibir la presencia de bacterias anaerobias obligatorias como
Blautia, Roseburia, Faecalibacterium y Bifidobacterium.30,34,38,43 Blautia está
asociada a individuos con diabetes mellitus.33 F. prausnitzii produce
metabolitos que bloquean la secreción de mediadores inflamatorios, y también
inducen la secreción de GLP1 mejorando la sensibilidad a la insulina, y
Roseburia, que aumenta tardíamente después de la cirugía, algunos estudios la
relacionan a la remisión de la diabetes mellitus.37
Bacterias del orden Clostridiales, y
Prevotella (Bacteroidetes), todas productoras de butirato, comienzan a aumentar
después de la cirugía.31 ,32,49 Streptococcus y Lactococcus, productores de
lactato, han sido usados como probióticos para mejorar la integridad
intestinal, desde que el lactato es crucial para los productores de butirato, y
por consiguiente de la salud colónica.35,53
Hungatella hathewayi (orden
Clostridiales) se asocia a la disminución de la masa grasa del tronco y la
hemoglobina glicosilada.34Alistipes shahii (familia Rikenellaceae),
se asocia con mejora metabólica. La disminución
de los niveles de bacterias de la familia Rikenellaceae está asociada a
enfermedad hepática no alcohólica (NAFL).50 Bacteroides uniformis, formador de
biofilm, aumenta en MG y disminuye en BG. B. uniformis está asociado a la
reestructuración de la colonización normal del intestino y reduce la producción
de citoquinas inflamatorias.33,44 Por el contrario, Bacteroides que liberan
sulfatos durante la degradación de la mucina, y especies de la familia
Dethosulfovibrionacea, como Bilophila sp, que reducen el sulfato produciendo
sulfuro de hidrógeno con efectos inflamatorios, al igual que Acidaminococcus y
Lachnospira, se orrelacionan negativamente con la pérdida de peso, y están
asociados a complicaciones de la obesidad, como síndrome metabólico y diabetes.45
Ruminococcus gnavus y R. torques, que disminuyen después de la cirugía,
producen transcialidasa para degradar mucina y están asociados a inflamación y
desórdenes metabólicos.34
Después de la cirugía se han podido
observar dos bacterias potencialmente dañinas,
relacionadas a enfermedad
de colon: Yokenella regensburgei (Proteobacteria) y Fusobacterium
varium. La primera aparece a los tres meses y se mantiene hasta los seis meses
post cirugía, y está asociada a inflamación. La segunda se asocia a cáncer de
colon.39
Otras bacterias reaccionan de manera
diferente de acuerdo a si se encuentran en un medio disbiótico o normal. B.
Thetaiotaomicron se asocia a la presencia de B. uniformis para producir un
efecto sinergístico en la disminución de peso, en la medida que el primero
aumenta el contenido graso en roedores libre de gérmenes.46 Anaerostipes
hadrus, productora de butirato, exacerba la colitis inducida en roedores,
pero que
en animales sanos
se relaciona a resultados
favorables.42 Akkermancia muciniphila (Verrucromicrobia) aumenta con ambas
cirugías. Bacteria capaz de degradar mucina, mejorar la barrera intestinal,
formar bio-films y contribuir al metabolismo de lactato. Se relaciona a la
pérdida de peso, disminución de la adiposidad, mejor perfil metabólico con
disminución de la resistencia a la insulina, y efectos antiinflamatorios. Se
asocia a remisión de diabetes mellitus. Puede aumentar con metformina y puede
mediar esta acción.34,35,37,38,43,48,53Mabey y col. describieron altas tasas de
A. municiphila en un paciente con remisión de la diabetes mellitus después del
tratamiento clínico (sin cirugía).33
Paganelli y col. al comparar las dos
cirugías, sin diferencias en la composición basal de la microbiota intestinal y
con resultados clínicos similares, sugieren que la cirugía bariátrica,
por sí misma, induce una alteración de la composición de la microbiota a largo
plazo, independiente de las modificaciones de la dieta en el post operatorio.40
Shen y col., al comparar dos grupos de obesos mórbidos de regiones geográficas
diferentes (New York y Barcelona), no encontraron diferencias postoperatorias
en los resultados clínicos ni en la composición de la microbiota intestinal,
por lo que sugieren que la cirugía, en estas condiciones específicas de
obesidad severa, podría contrarrestar las influencias genéticas, ambientales o
dietéticas sobre el microbioma.41
La
cirugía bariátrica produce cambios en el metabolismo
Microbiano intestinal
En muchos estudios la alteración en
las vías metabólicas y funciones del microbioma han sido configurados usando
KEGG (Kyoto Encyclopedia of Gens and Genomas).58 KEGG usa una base de datos que
asigna significados funcionales a genes y genomas usando ortólogos para
predecir cambios funcionales de alto nivel en la forma de mapas de vías
metabólicas.
Los microbios pueden actuar
sinérgicamente en la producción y degradación de metabolitos, reflejando
interacciones entre especies que son fisiológicamente importantes, efecto que
aparece muy temprano después de la cirugía41. Un factor muy importante es la interrelación
de la microbiota intestinal con los ácidos biliares. Las bacterias lo usan como
sustrato de biotransformación en el colon, produciéndose una verdadera
comunicación entre ambos, con efectos beneficiosos en el metabolismo del
huésped a través de los receptores Farnesoide X y TGR5.35,38
En una revisión encontraron que la
microbiota intestinal post operatoria de sujetos con obesidad mórbida fue
similar a la de sujetos con sobrepeso o con obesidad leve, con aumento de GLP1,
GLP2, PYY y TMAO y disminución de BCCA (aminoácidos ramificados esenciales),
que en su conjunto dieron como resultado la disminución de glucosa, insulina,
triglicéridos, colesterol total, LDL, HOMA IR, disminución del apetito, y
remisión de diabetes mellitus.59 Samszuck y col. encontraron, a los 6 meses de
la cirugía, cambios metabólicos similares en ambas técnicas (BG y MG), como el
metabolismo de aminoácidos y fosfolípidos, y otros que eran diferentes, como el
metabolismo de sustratos que contienen sulfuro en el BG y el metabolismo de
p-cresol y carbohidratos en la MG, en pacientes con los mismos resultados
clínicos post operatorios.60
LI y
col. concluyeron que
el BG induce
un conjunto de efectos que
incluyen el metabolismo
de aminoácidos (tirosina, fenialalanina, triptofano y metionina) y ácidos grasos
mitocondriales, lo que podría contribuir no solo a la pérdida de peso y al
efecto antidiabético, sino también a procesos metabólicos externos al sistema
digestivo.51 Ellos sugieren que los cambios en la microbiota intestinal
contribuyen al co-metabolismo bacteria-huésped probablemente dirigidos por las
comunidades bacterianas favorecidas por las condiciones de la cirugía. Sánchez
y col. concluyeron que la capacidad de las bacterias colónicas para extraer
energía del azúcar es más baja después de la cirugía como consecuencia de la
reducción del número de rutas por las cuales la microbiota puede metabolizar
azúcar.47 Este sistema detox-redox post cirugía, de menor generación de
energía, podría ser la base para la pérdida de peso y el control metabólico de
la diabetes.
Trasplante
de material fecal (TMF)
El trasplante de material fecal (TMF)
consiste en la administración de una solución de material fecal debidamente
procesada, procedente de un donante sano, en el tracto gastrointestinal de otro
individuo, preferencialmente por sonda nasogástrica/nasoyeyunal o por
colonoscopía, con el fin de manipular las características de la microbiota del
receptor.61 También puede ser administrado con cápsulas vía oral.62 El TMF
tiene buenos resultados comprobados en el tratamiento de la diarrea refractaria
por Clostridium difficile.63 Varios estudios están evaluando el papel del TMF
en diferentes enfermedades, en especial enfermedad inflamatoria intestinal y
síndrome metabólico.64-66
No se ha podido determinar una
relación de causalidad entre los beneficios de la cirugía bariátrica y las
alteraciones que produce en la microbiota intestinal.67 El TMF sugiere un
posible efecto causal de la alteración de la microbiota intestinal sobre el
peso y el metabolismo del receptor, mucho más claro en estudios experimentales
en roedores que en estudios clínicos en humanos.
Los trabajos de Liou y col. y
Tremaroli y col. sugieren una transferencia, vía microbiota, de los efectos
beneficiosos sobre el peso y la adiposidad, de los donadores a los
receptores.68,69 Tremaroli trasplantó material fecal de sujetos obesos post
operados de cirugía bariátrica a roedores libres de gérmenes obteniendo menor
adiposidad y peso en los receptores; y, Liou trasplantó material fecal de
roedores obesos a roedores libres de gérmenes obteniendo el efecto contrario.
La transferencia en bloque de la microbiota intestinal humana contenida en el
material fecal de un donador magro saludable a un receptor obeso transfiere
temporalmente el fenotipo beneficioso del primero al segundo, mejorando la
adiposidad y el peso. El TMF de donadores magros mejora la sensibilidad de la
insulina en receptores obesos con síndrome metabólico, y las mejores respuestas
se encuentran cuando la microbiota basal del receptor presenta riqueza genética
microbiana alta o cuando el donador está metabólicamente saludable.70
CONCLUSIONES
Desde que se describió que las mejoras
metabólicas después de la cirugía bariátrica eran independientes de la pérdida
de peso, se han descrito diferentes mecanismos de acción de los diferentes
factores que participan en este proceso. Uno de los factores más estudiados en
estos últimos años es la microbiota intestinal.
La cirugía bariátrica modifica de
manera importante la microbiota
intestinal: aumenta la
diversidad y altera la abundancia relativa de algunas
especies y grupos bacterianos, conformando una comunidad cuyos metabolitos
interactúan con el huésped para mejorar el perfil metabólico, especialmente de
los carbohidratos y los lípidos, contribuyendo al control de la glicemia y del
peso. Los cambios en la microbiota intestinal podrían deberse a un conjunto de
factores asociados a los cambios anatómicos de la cirugía bariátrica. La
restricción de la dieta, el aumento del tránsito intestinal, los cambios
intraluminales del pH y de los niveles de oxígeno, la alteración de los ácidos
biliares, la disminución del área de absorción de nutrientes y la digestión
retrasada al yeyuno distal-íleon proximal, inducen cambios en la conformación y
metabolismo bacterianos que, a través de un complejo sistema de interacción,
modula el metabolismo del huésped.
La cirugía bariátrica induce un
aumento de los filos Fusobacteria, Proteobacteria y Verrucomicrobia; y una
disminución del filo Firmicutes. Akkermansia muciniphila podría ser una de las
bacteria-clave presentes en la microbiota intestinal post cirugía bariátrica
que se asocia con la disminución del peso y el control glicémico del huésped.
El metabolismo bacteriano
probablemente en los primeros tres meses sea de adaptación, luego del cual
consigue una estabilidad en el tiempo, caracterizándose por un sistema detox-redox
con menor generación de energía, lo que podría explicar los resultados
metabólicos postoperatorios. El trasplante de material fecal sugiere una
relación de causa- efecto entre las comunidades microbianas trasplantadas y los
efectos metabólicos y/o terapéuticos que producen en el receptor, pudiendo ser
una verdadera transferencia de fenotipo. Este trasplante de heces transfiere la
microbiota completa, es decir, no solo las bacterias, sino también virus,
hongos y arqueas, por lo que sería interesante conocer el rol que juegan cada
uno de estos grupos microbianos y su
relación con el hospedero. Por otro lado, parece que la conformación de una
comunidad bacteriana (diversidad y abundancias relativas) es más importante que
la participación individual de las mismas, en la medida que bacterias con
efectos nocivos en una determinada situación tienen efectos beneficiosos en
otra situación, como, por ejemplo, el medio intraluminal colónico después de la
cirugía bariátrica.
Los resultados heterogéneos de los
estudios clínicos sobre microbiota intestinal pueden deberse a variaciones
entre los sujetos, como etnia, sexo, región geográfica; a variaciones en el
proceso de toma de muestra y conservación de las mismas; a variaciones en
los métodos utilizados
para el estudio taxonómico y
metabólico de las
bacterias; a variaciones en las
asociaciones de los metabolitos bacterianos con los metabolitos del huésped
provenientes del suero, los tejidos o las heces; y, a variaciones de los
métodos estadísticos utilizados.
Dilucidar los mecanismos de acción
puede tener muchas ventajas en el campo terapéutico de la obesidad y las
enfermedades asociadas al sobrepeso, como mejorar el tratamiento clínico
farmacológico y no farmacológico, determinar en el preoperatorio los posibles
resultados del tratamiento quirúrgico, y mantener los resultados de la cirugía
evitando el aumento del peso y el retorno de las enfermedades asociadas.
De la presente revisión narrativa se
concluye que la cirugía bariátrica induce cambios importantes en la microbiota
intestinal, donde los metabolitos bacterianos interactúan con el huésped
mejorando el perfil metabólico y contribuyendo a la pérdida del peso.
REFERENCIAS
BIBLIOGRÁFICAS
1. Jaacks LM,Vandevijvere S, Pan A, McGowan CJ,Wallace C, Imamura F, Mozaffarian D, Swinburn B, Ezzati M.The
obesity transition: stages
of the global epidemic. Lancet
Diabetes Endocrinol. 2019 Mar;7(3):231- 240. doi: 10.1016/S2213-8587(19)30026-9.
2. Apovian CM. Obesity:
definition, comorbidities, causes,
and burden.
Am J Manag Care.
2016 Jun;22(7 Suppl):s176-185.
3. Le Magueresse-Battistoni B.Adipose
tissue and endocrine-disrupting chemicals: does sex matter?
Int J Environ Res Public Health. 2020 Dec
15;17(24):9403. doi: 10.3390/ijerph17249403.
4. Jäger P,Wolicki
A, Spohnholz J, Senkal M. Review: Sex-specific aspects in the bariatric treatment of severely obese women. Int J Environ Res Public Health. 2020
Apr 15;17(8):2734. doi: 10.3390/ ijerph17082734. PMID: 32326591.
5. Riccio P, Rossano R.
The human gut microbiota is neither an organ nor a commensal. FEBS Lett. 2020 Oct;594(20):3262-3271.
doi:10.1002/1873-3468.13946
6. Shanahan F, Ghosh TS, O’Toole PW.
The healthy microbiome-what is the definition of a healthy
gut microbiome? Gastroenterology. 2021 Jan;160(2):483-494. doi:10.1053/j.gastro.2020.09.057
7. Nodari R, Drancourt M, Barbieri R. Paleomicrobiology of the
human digestive tract:A
review. Microb Pathog. 2021 Aug;157:104972.
doi:10.1016/j.micpath.2021.104972
8. Tochitani S.Vertical transmission of gut microbiota: Points of action of environmental factors
influencing brain development. Neurosci
Res. 2021 Jul;168:83-94. doi:10.1016/j.neures.2020.11.006
9. Schwartz DJ, Langdon AE, Dantas G.
Understanding the impact of antibiotic perturbation on the human microbiome.
Genome Med. 2020 Sep 28;12(1):82. doi:10.1186/s13073-020-00782-x
10.
Tan GSE, Tay HL, Tan SH, Lee TH, Ng TM, Lye DC. Gut microbiota
modulation: implications for infection control and antimicrobial stewardship.
Adv Ther. 2020 Oct;37(10):4054-4067. doi:10.1007/ s12325-020-01458-z
11.
Alemao CA, Budden KF, Gomez HM, Rehman SF, Marshall JE, Shukla SD, et
al. Impact of diet and the bacterial microbiome on the mucous barrier and
immune disorders. Allergy. 2021 Mar;76(3):714-734. doi:10.1111/all.14548
12.
Sebastián Domingo JJ, Sánchez C. From the intestinal flora to the
microbiome. Rev Espanola Enfermedades Dig Organo Of Soc Espanola Patol Dig.
2018 Jan;110(1):51 doi:10.17235 / reed.2017.4947/2017
13.
Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, et
al. Diversity of the human intestinal microbial flora. Science. 2005 Jun
10;308(5728):1635-8. doi:10.1126/science.1110591
14.
Kijng CH, Desai H, Sylvetsky AC, LoTempio J, Ayanyan S, Carrie J, et
al. Baseline human gut microbiota profile in healthy people and standard
reporting template. PLoS One. 2019 Sep 11;14(9):e0206484.
doi:10.1371/journal.pone.0206484
15.
Rastelli M, Cani PD, Knauf C. The gut microbiome influences host
endocrine functions. Endocr Rev. 2019 Oct 1;40(5):1271–84.
soi:10.1210/er.2018-00280
16.
Dogra SK, Doré J, Damak S. Gut microbiota resilience: Definition, link
to health and strategies for intervention. Front Microbiol. 2020 Sep
15;11:572921. doi:10.3389/fmicb.2020.572921
17.
Liu BN, Liu XT, Liang ZH,Wang JH. Gut microbiota in obesity. World J
Gastroenterol. 2021 Jul 7;27(25):3837-3850. doi:10.3748/wjg.v27. i25.3837
18.
Gasmi A, Mujawdiya PK, Pivina L, Do-a A, Semenova Y, Benahmed AG, et
al. Relationship between gut microbiota, gut hyperpermeability and obesity.
Curr Med Chem. 2021;28(4):827-839. doi:10.2174/09298 67327666200721160313
19.
Zhou L, Xiao X.The role of gut microbiota in the effects of maternal
obesity during pregnancy on offspring metabolism. Biosci Rep. 2018 Apr
13;38(2):BSR20171234. doi:10.1042/BSR20171234
20.
Li R, Li Y, Li C, Zheng D, Chen P. Gut microbiota and endocrine
disorder. Adv Exp Med Biol. 2020;1238:143–64. doi:10.1007/978-981- 15-2385-4_9
21.
2020-03-02-Conferencia-D.-Santiago-Vega_Microbiota-intestinal. pdf
[Internet]. [cited 2021 Jun 26]. Available from: http://racve.es/
files/2020/03/2020-03-02-Conferencia-D.-Santiago-Vega_
Microbiota-intestinal.pdf
22.
Muscogiuri G, Cantone E, Cassarano S, Tuccinardi D, Barrea L, Savastano
S, et al. Gut microbiota: a new path to treat obesity. Int J Obes Suppl. 2019
Apr;9(1):10–9. doi:10.1038 / s41367-019-0011-7
23.
Pontiroli AE, Ceriani V, Tagliabue E. Compared with Controls, Bariatric
Surgery Prevents Long-Term Mortality in Persons with Obesity Only Above Median
Age of Cohorts: a Systematic Review and Meta-Analysis. Obes Surg. 2020
Jul;30(7):2487–96. doi:10.1007/ s11695-020-04530-3
24.
Kolotkin RL, Andersen JR. A systematic review of reviews: exploring the
relationship between obesity, weight loss and health-related quality of life.
Clin Obes. 2017 Oct;7(5):273–89. doi:10.1111/ cob.12203
25.
Bariatric Surgery Procedures | ASMBS [Internet]. American Society for
Metabolic and Bariatric Surgery. [cited 2021 Jun 26]. Available from:
https://asmbs.org/patients/bariatric-surgery-procedures
26.
Moffett RC,Docherty NG, le Roux CW.The altered enteroendocrine
reportoire following roux-en-Y-gastric bypass
as an effector
of weight loss and improved glycaemic control. Appetite. 2021 Jan
1;156:104807. doi:10.1016/j.appet.2020.104807
27.
Lupien-Meilleur J, Andrich DE, Quinn S, Micaelli-Baret C, St-Amand R,
Roy D, et al. Interplay between gut microbiota and gastrointestinal peptides:
potential outcomes on the regulation of glucose control. Can J Diabetes. 2020
Jun;44(4):359–67. doi:10.1016/j.jcjd.2019.10.006
28.
Mazidi M, de Caravatto PPP, Speakman JR, Cohen RV. Mechanisms of
action of surgical
interventions on weight-related diseases: the potential role of bile acids.
Obes Surg. 2017 Mar;27(3):826–36. doi:10.1007/s11695-017-2549-1
29.
Jain AK, le Roux CW, Puri P, Tavakkoli A, Gletsu-Miller N, Laferrère B,
et al. Proceedings of the 2017 ASPEN Research Workshop-Gastric Bypass: Role of
the Gut. JPEN J Parenter Enteral Nutr. 2018 Feb;42(2):279–95. doi: 10.1002 /
jpen.1121
30.
Steinert RE, Rehman A, Souto Lima EJ, Agamennone V, Schuren FHJ, Gero
D, et al. Roux-en-Y gastric bypass surgery changes fungal and bacterial
microbiota in morbidly obese patients-A pilot study. PloS One.
2020;15(7):e0236936. doi:10.1371/journal.pone.0236936
31.
Yu D, Shu X-O, Howard EF, Long J, English WJ, Flynn CR. Fecal
metagenomics and metabolomics reveal gut microbial changes after bariatric
surgery. Surg Obes Relat Dis Off J Am Soc Bariatr Surg. 2020
Nov;16(11):1772–82. doi:10.1016/j.soard.2020.06.032
32.
Chen G, Zhuang J, Cui Q, Jiang S,Tao W, Chen W, et al.Two bariatric
surgical procedures differentially alter
the intestinal microbiota in obesity patients. Obes Surg.
2020 Jun;30(6):2345–61. doi: 10.1007 /s11695-020-04494-4
33.
Mabey JG, Chaston JM, Castro DG, Adams TD, Hunt SC, Davidson LE. Gut
microbiota differs a decade after bariatric surgery relative to a nonsurgical
comparison group. Surg Obes Relat Dis Off J Am Soc Bariatr Surg. 2020 Sep;16(9):1304–11.
doi:10.1016/j. soard.2020.04.006
34.
Farin W, Oñate FP, Plassais J, Bonny C, Beglinger C,Woelnerhanssen B,
et al. Impact of laparoscopic Roux-en-Y gastric bypass and sleeve gastrectomy
on gut microbiota: a metagenomic comparative analysis. Surg Obes Relat Dis Off
J Am Soc Bariatr Surg. 2020 Jul;16(7):852–62. doi:10.1016/j.soard.2020.03.014
35.
Ilhan ZE, DiBaise JK, Dautel SE, Isern NG, Kim Y-M, Hoyt DW, et al.
Temporospatial shifts in the human gut microbiome and metabolome after gastric
bypass surgery. NPJ Biofilms Microbiomes. 2020 Mar 13;6(1):12. doi: 10.1038 /
s41522-020-0122-5
36.
Pajecki D, de Oliveira LC, Sabino EC, de Souza-Basqueira M, Dantas ACB,
Nunes GC, et al.
Changes in the
intestinal microbiota of superobese patients after bariatric
surgery. Clin Sao Paulo Braz. 2019;74:e1198. doi: 10.6061 / clinics / 2019 /
e1198
37.
Lee CJ, Florea L, Sears CL, Maruthur N, Potter JJ, Schweitzer M, et al.
Changes in gut microbiome after bariatric surgery versus medical weight loss in
a pilot randomized trial. Obes Surg. 2019 Oct;29(10):3239–45. doi: 10.1007 /
s11695-019-03976-4
38.
Sánchez-Alcoholado L, Gutiérrez-Repiso C, Gómez-Pérez AM,
García-Fuentes E, Tinahones FJ, Moreno-Indias I. Gut microbiota adaptation
after weight loss by Roux-en-Y gastric bypass or sleeve gastrectomy bariatric
surgeries. Surg Obes Relat Dis Off J Am Soc Bariatr Surg. 2019
Nov;15(11):1888–95. doi: 10.1016 / j.soard. 2019.08.551
39.
Palmisano S, Campisciano G, Silvestri M, Guerra M, Giuricin M,
Casagranda B, et al. Changes in Gut Microbiota Composition after Bariatric
Surgery: a New Balance to Decode. J Gastrointest Surg Off J Soc Surg Aliment
Tract. 2020 Aug;24(8):1736–46. doi: 10.1007 / s11605-019-04321-x
40.
Paganelli FL, Luyer M, Hazelbag CM, Uh H-W, Rogers MRC,Adriaans D, et
al. Roux-Y Gastric Bypass and Sleeve Gastrectomy directly change gut microbiota
composition independent of surgery type. Sci Rep. 2019 Jul 29;9(1):10979. doi:
10.1038 / s41598-019-47332-z
41.
Shen N, Caixàs A,Ahlers M, Patel K, Gao Z, Dutia R, et al. Longitudinal
changes of microbiome composition and microbial metabolomics after surgical
weight loss in individuals with obesity. Surg Obes Relat Dis Off J Am Soc
Bariatr Surg. 2019 Aug;15(8):1367–73. doi: 10.1016 / j.soard.2019.05.038
42. Aron-Wisnewsky J, Prifti E, Belda E, Ichou F, Kayser BD,
Dao MC, et al. Major
microbiota dysbiosis in severe obesity:
fate after bariatric surgery. Gut. 2019 Jan;68(1):70–82. doi:
10.1136 / gutjnl-2018-316103
43. Kikuchi R, Irie J, Yamada-Goto N, Kikkawa E, Seki Y, Kasama K, et al. The impact of laparoscopic
sleeve gastrectomy with duodenojejunal bypass on intestinal microbiota differs
from that of laparoscopic sleeve gastrectomy in Japanese patients with obesity.
Clin Drug Investig. 2018 Jun;38(6):545–52. doi: 10.1007 / s40261-018-
0638-0
44. Campisciano G, Palmisano S, Cason C, Giuricin M, Silvestri M,
Guerra M, et al. Gut microbiota characterisation in obese patients before and
after bariatric surgery. Benef Microbes.
2018 Apr 25;9(3):367–73. doi: 10.3920
/ BM2017.0152
45. Sanmiguel CP, Jacobs
J, Gupta A, Ju T, Stains J,
Coveleskie K, et al. Surgically induced changes
in gut microbiome and hedonic
eating as related to weight
loss: preliminary findings in obese women undergoing bariatric surgery. Psychosom Med.
2017 Oct;79(8):880–7. doi: 10.1097
/ PSY.0000000000000494
46. Liu R, Hong J, Xu X, Feng Q, Zhang D, Gu Y, et al. Gut microbiome and serum metabolome
alterations in obesity and after weight-loss intervention. Nat Med.
2017 Jul;23(7):859–68. doi:
10.1038 / nm.4358
47. Sanchez-Carrillo S, Ciordia S, Rojo D, Zubeldia-Varela E, Méndez- García C, Martínez-Martínez M, et
al. A body weight loss- and health-promoting gut microbiota is established
after bariatric surgery in individuals with severe obesity.
J
Pharm Biomed Anal. 2021 Jan 30;193:113747. doi:
10.1016 / j.jpba.2020.113747
48. Medina DA, Pedreros JP, Turiel
D, Quezada N, Pimentel F, Escalona A, et al. Distinct patterns in
the gut microbiota after surgical or medical therapy in obese patients.
PeerJ. 2017;5:e3443. doi: 10.7717/peerj.3443
49. Lin BY, Lin W-D, Huang
C-K, Hsin M-C, Lin W-Y, Pryor AD. Changes
of gut microbiota between different weight reduction programs. Surg Obes Relat Dis Off J Am Soc Bariatr
Surg. 2019 May;15(5):749–58. doi: 10.1016 / j.soard.2019.01.026
50. Wang F-G, Bai R-X,Yan
W-M,Yan M, Dong L-Y, Song M-M. Differential composition of gut
microbiota among healthy volunteers, morbidly obese patients and post-bariatric
surgery patients. Exp Ther Med.
2019 Mar;17(3):2268–78. doi: 10.3892
/ etm.2019.7200
51. Li JV, Ashrafian H,
Sarafian M, Homola D, Rushton L,
Barker G, et al. Roux-en-Y gastric bypass-induced bacterial perturbation
contributes to altered host-bacterial co-metabolic phenotype. Microbiome. 2021 Jun 14;9(1):139. doi: 10.1186 / s40168-021-
01086-x
52. Tabasi M, Eybpoosh
S, Siadat SD, Elyasinia F, Soroush
A, Bouzari
S. Modulation of the gut microbiota and serum biomarkers after
laparoscopic sleeve gastrectomy: a 1-year follow-up study. Obes Surg. 2021 May;31(5):1949–56. doi: 10.1007 /
s11695-020-05139-2
53. Fouladi F, Carroll
IM, Sharpton TJ,
Bulik-Sullivan E, Heinberg
L, Steffen KJ, et al. A microbial signature following bariatric surgery
is robustly consistent across multiple cohorts.
Gut Microbes. 2021
Dec;13(1):1930872. doi: 10.1080 / 19490976.2021.1930872
54. Ben Izhak M, Eshel A, Cohen R, Madar-Shapiro L, Meiri H, Wachtel
C, et al. Projection of gut microbiome pre- and post-bariatric surgery
to predict surgery
outcome. mSystems. 2021 Jun 29;6(3):e0136720. doi:
10.1128 / mSystems.01367-2
55. Stefura T, Zapała B, Gosiewski T, Krzysztofik M, Skomarovska O, Major P. Relationship between bariatric surgery
outcomes and the preoperative gastrointestinal microbiota: a cohort study. Surg
Obes Relat Dis Off J Am Soc Bariatr Surg. 2021 May;17(5):889–99. doi: 10.1016 / j.soard.2021.01.011
56. Stefura T, Zapała
B, Stój A, Gosiewski T, Skomarovska O, Krzysztofik M, et al. Does postoperative
oral and intestinal microbiota correlate with the weight-loss following bariatric
surgery?-A cohort study.J Clin
Med.2020 Nov 27;9(12):E3863. doi: 10.3390 / jcm9123863
57. Ilhan ZE, DiBaise JK, Isern NG, Hoyt DW, Marcus AK, Kang D-W, et al. Distinctive microbiomes and
metabolites linked with weight loss after gastric
bypass, but not gastric banding. ISME J. 2017
Sep;11(9):2047–58. doi: 10.1038
/ ismej.2017.71
58. Ogata H, Goto S, Sato K, Fujibuchi W, Bono H, Kanehisa
M. KEGG: Kyoto Encyclopedia of Genes
and Genomes. Nucleic Acids Res.
1999 Jan 1;27(1):29-34. doi: 10.1093 / nar / 27.1.29
59. Magouliotis DE, Tasiopoulou VS,
Sioka E, Chatedaki C, Zacharoulis D. Impact
of Bariatric surgery on metabolic and gut microbiota profile: A systematic
review and meta- analysis. Obes Surg. 2017 May;27(5):1345-1357. doi:
10.1007 / s11695-017-2595-8
60. Samczuk P, Luba M,
Godzien J, Mastrangelo A, Hady HR, Dadan J, et al. “Gear mechanism” of
bariatric interventions revealed by untargeted metabolomics. J Pharm Biomed Anal. 2018 Mar 20;151:219-226. doi:
10.1016 / j.jpba.2018.01.016
61. Vindigni SM, Surawicz CM. Fecal Microbiota Transplantation. Gastroenterol Clin
North Am. 2017
Mar;46(1):171-185. doi: 10.1016/j.gtc.2016.09.012
62. Gulati M, Singh SK, Corrie L, Kaur IP, Chandwani L. Delivery
routes for faecal microbiota transplants:Available, anticipated and aspired.
Pharmacol Res.
2020 Sep;159:104954. doi:
10.1016 / j.phrs.2020.104954
63. Tixier EN, Verheyen E,
Ungaro RC, Grinspan AM. Faecal microbiota transplant decreases mortality in
severe and fulminant Clostridioides
difficile infection in critically ill patients. Aliment Pharmacol Ther. 2019 Nov;50(10):1094- 1099. doi: 10.1111 / apt.15526
64. Green JE, Davis JA, Berk M, Hair C, Loughman A, Castle D, et al. Efficacy and safety of fecal
microbiota transplantation for the treatment of diseases other than Clostridium difficile infection: a systematic review
and meta-analysis. Gut Microbes. 2020 Nov 9;12(1):1-25.doi:10.1080 / 19490976.2020.1854640
65. Colman RJ, Rubin DT. Fecal
microbiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta-analysis. J Crohns Colitis. 2014
Dec;8(12):1569-81. doi: 10.1016 / j.crohns.2014.08.006
66. de Groot P, Scheithauer T, Bakker
GJ, Prodan A, Levin E, Khan
MT, et al. Donor metabolic
characteristics drive effects of faecal microbiota transplantation on recipient
insulin sensitivity, energy expenditure and intestinal transit time. Gut. 2020 Mar;69(3):502-512. doi:
10.1136 / gutjnl- 2019-318320
67. Walter J, Armet AM, Finlay BB,
Shanahan F. Establishing or exaggerating causality for the gut
microbiome: Lessons from human microbiota-associated rodents. Cell. 2020 Jan 23;180(2):221-232. doi: 10.1016
/ j.cell.2019.12.025
68. Liou AP, Paziuk M,
Luevano JM Jr, Machineni S, Turnbaugh
PJ, Kaplan LM. Conserved shifts in the gut microbiota due to gastric
bypass reduce host weight and adiposity.
Sci Transl Med.
2013 Mar 27;5(178):178ra41. doi: 10.1126 / scitranslmed.3005687
69. Tremaroli V, Karlsson F, Werling M, Ståhlman M, Kovatcheva-Datchary
P, Olbers T, et al. Roux-en-Y gastric bypass and vertical banded
gastroplasty induce long-term
changes on the human gut
microbiome contributing to fat mass regulation. Cell Metab. 2015 Aug 4;22(2):228-38. doi: 10.1016 /
j.cmet.2015.07.009
70. Aron-Wisnewsky J, Clément K, Nieuwdorp M. Fecal microbiota
transplantation: A future
therapeutic option for
obesity/diabetes? Curr Diab Rep. 2019
Jun 27;19(8):51. doi: 10.1007 / s11892-019-1180-z
Cita como:
Vigil-Guerrero RE, Gasco M, Gonzales
GF. La cirugía bariátrica modifica la diversidad bacteriana y los metabolitos
de la microbiota intestinal mejorando el perfil metabólico del huésped y
contribuyendo a la reducción del peso. Rev Soc Peru Med Interna. 2021;34(4):162-172.
DOI: https://doi.org/10.36393/spmi.v34i4.632
CORRESPONDENCIA:
Roberto
E.Vigil-Guerrero
roberto.vigil.g@upch.pe
Fecha
de recepción: 17-09-2021.
Fecha
de aceptación: 05-11-2021.
Contribución de los
autores:Vigil-Guerrero RE: Idea del estudio, revisión de artículos, análisis e
interpretación de los datos, redacción del resumen, versión final aprobada.
Gonzales GF: idea del estudio, revisión crítica y versión final aprobada Gasco
M: revisión de artículos, revisión crítica y versión final aprobada.
Conflicto de interés: Los autores
declaran no tener cualquier relación, condición o circunstancia que pueda
reducir la objetividad en la interpretación de la revisión.
Financiación: los autores han
financiado íntegramente todas las etapas de la revisión.