DOI:
https://doi.org/10.36393/spmi.v34i4.634
RESUMEN
Paciente varón de 63 años de edad,
diabético y en tratamiento con insulina, con dolor y aumento de volumen a nivel
del hemitórax anterior izquierdo, con estudio de ecpgrafía
y tomografía compatible con colección a nivel del músculo pectoral mayor. En la
punción se obtuvo un material purulento y fétido, confirmándose el diagnóstico de
piomiositis. Se aisló Streptococcus
constellatus en el cultivo del pus. Con pobre respuesta
a tratamiento médico inicial, requirió drenaje quirúrgico y cobertura
antibiótica amplia
Palabras claves: piomiositis, diabetes mellitus, Streptococcus
constellatus.
ABSTRACT
A 63-year-old male
patient, diabetic and on insulin treatment,
with pain and increased volume at the level of
the left anterior hemithorax, with ultrasound and tomography study compatible with collection at the level of the
pectoralis major muscle. In the puncture a purulent and fetid material was obtained, confirming the diagnosis
of pyomyositis. Streptococcus constellatus was isolated in pus culture.With poor
response to initial medical
treatment, it required surgical drainage and broad antibiotic coverage.
Keywords: pyomyositis,
diabetes mellitus, Streptococcus constellatus.
INTRODUCCIÓN
La piomiositis
primaria es la infección bacteriana del músculo estriado con formación de
abscesos, ocasionada por diseminación hematógena del agente causal, no asociada
con diseminación por contigüidad de piel,
partes blandas ni hueso.1,2 Se relaciona con condiciones que deterioran
los mecanismos generales de
defensa del huésped, como HIV/sida, diabetes, desnutrición, neoplasias,
enfermedades autoinmunes, hepatopatías crónicas, drogadicción endovenosa, uso
de esteroides, etc., pudiendo asociarse a factores locales, como injurias
musculares, microtraumatismos o estrés muscular.
Los músculos comúnmente afectados son
los grandes grupos musculares de la cintura pelviana y de miembros inferiores,
pudiendo ser unifocal o multifocal. Los sitios menos
afectados son la pared abdominal, pared torácica y las regiones paraespinales.3
Según la serie de Bickels
y col., en 452 aislamientos en pacientes con piomiositis
primaria, el principal agente etiológico fue Staphylococcus
aureus (77%), siguiendo en frecuencia estreptococos
(11%), Escherichia coli (2,4%)
y, menor al 2%, Salmonella enteritidis, Mycobacterium tuberculosis, Streptococcus
pneumoniae. Otros microorganismos involucrados en
casos aislados han sido Klebsiella pneumoniae, Yersinia enterocolitica,
Neiseria
gonorrhoeae, Aeromonas hydrophila, anaerobios y
hongos. El cuadro clínico se caracteriza por fiebre, síntomas locales como dolor,
tumefacción y aumento de tamaño del músculo. Para el diagnóstico se requiere de
la sospecha clínica y del aporte de las imágenes.4 Las anormalidades en el
laboratorio difícilmente colaboran en establecer el diagnóstico, por lo que el
reconocimiento temprano como el tratamiento oportuno son las claves para evitar
cuadros graves.
PRESENTACIÓN DEL CASO
El caso corresponde a un varón de 63
años, natural y procedente de Lima, con antecedentes de hipertensión arterial,
diabetes mellitus con insulinoterapia y con controles irregulares de glucosa.
Ingresó por primera vez al servicio de emergencia por presentar 10 días de dolor
torácico anterior, entre las regiones esternal y pectoral mayor izquierda, sin
antecedente de trauma, rascado y/o herida en la zona. Al examen físico
de ingreso, se evidenció aumento de volumen y dolor a la palpación a nivel de
tórax anterior izquierdo, sin eritema ni calor en la piel suprayacente. Recibió
analgésicos parenterales con mejoría parcial. Se solicitó una ecografía de partes
blandas, la cual reportó signos ecográficos compatibles con absceso en formación
en partes blandas de la pared torácica (Figura 1). Se indicó clindamicina 300
mg cada 8 horas por 7 días e Ibuprofeno 400 mg cada 12 horas por 5 días y se le
dio de alta.
Cuatro días después retornó por
persistencia del dolor, que se extendía al miembro superior izquierdo, asociado
a malestar general y escalofríos. Al examen, se objetivó dolor a la palpación, aumento
de volumen a nivel esternal, de consistencia renitente y eritema. Se decidió drenaje
de la colección a nivel esternal, obteniendo secreción purulenta, muy fétida, aprox.
100 cc, se tomó muestra para cultivo, se dejó un dren
y se hospitalizó con diagnóstico de absceso de pared torácica, iniciándose ciprofloxacina
más clindamicina por vía endovenosa.
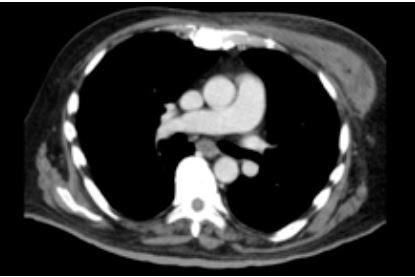
Figura 1. Ecografía:
colección en la región pectoral izquierda.
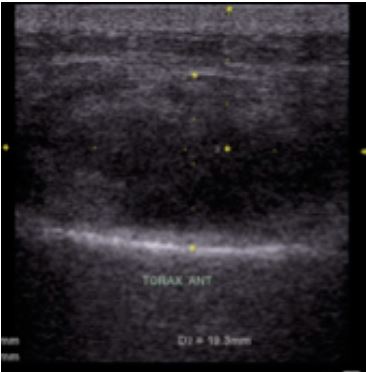
Figura 2. Día 1 de
hospitalización - día 15 de enfermedad. colección densa pectoral izquierda.
En los exámenes iniciales de ingreso
se evidenció hemoglobina 12,8 g/dl, plaquetas 385 mil, leucocitos 23 700 células/mm3
con 20 140 segmentados (13% abastonados) y 2 130 linfocitos; glucosa basal 158
mg/dl, creatinina 0,79 mg/dl, urea 60 mg/dl, PCR 32 mg/dl.
Se evidenció secreción purulenta por
el drenaje a nivel del esternón y nuevo aumento de volumen de consistencia
renitente con eritema a nivel pectoral izquierdo, por lo que se realiza
tomografía de tórax que mostró una colección densa a nivel del pectoral
izquierdo de volumen aprox. 60cc (Figura 2). El cultivo de secreción del primer
drenaje y dos hemocultivos fueron negativos. Ante la progresión clínica, se decidíó un nuevo drenaje a nivel del pectoral mayor, obteniéndose
150 cc de secreción “achocolatada” y se tomaron
nuevos cultivos.
Durante su cuarto día de estancia
hospitalaria se notó extensión de edema a cara anterior del brazo izquierdo,
con empastamiento y aumento de volumen a
lo largo del miembro superior
izquierdo, en forma homogénea. La tomografía de tórax control y con extensión
al miembro superior izquierdo (Figuras 3a y 3b) evidenció una colección de
contenido líquido y aéreo a nivel del pectoral mayor izquierdo, aprox. 200 cc, que se extendía a la región esternal y axilar, con volumen
aprox. de 100cc, comprometiendo también al tejido celular subcutáneo
de la cara interna del brazo hasta el codo, adyacente a la fascia muscular
con volumen de 60cc. y densidades aéreas hasta el tercio proximal del brazo. A
nivel de antebrazo se observó una colección laminar. El derrame pleural bilateral
observado en la tomografía fue atribuido a falla cardiaca por sobrehidratación,
lo cual se corrigió en los días siguientes. Se cambió la cobertura antibiótica
con vancomicina 1 gramo cada 12 horas y meropenem 1 gramo cada 8 horas. Sin
embargo, el paciente persistió con dolor a lo largo de región torácica anterior
izquierda, extendiéndose a la región axilar y miembro superior izquierdo
ipsilateral, drenajes de esternón y pectoral mayor con abundante secreción
purulenta fétida, los exámenes de laboratorio control con persistencia de leucocitosis
con desviación izquierda y PCR incrementado, sin mejoría a las 72 horas de haber
cambiado de antibióticos. Debido a la mala evolución clínica y laboratorial, se
decidió el ingreso a sala de operaciones para debridamiento
y colocación de nuevo drenaje a nivel axilar. Los hallazgos operatorios
reportaron abundante colección purulenta a nivel del músculo pectoral mayor
izquierdo, con extensión a la región infraclavicular, esternal, hueco axilar y
hombro izquierdo, adenopatías axilares sin alteraciones macroscópicas, se drenó
400 cc de líquido purulento que se envió a estudio y
se colocó nuevo dren a nivel axilar, manteniendo la cobertura antibiótica instaurada.
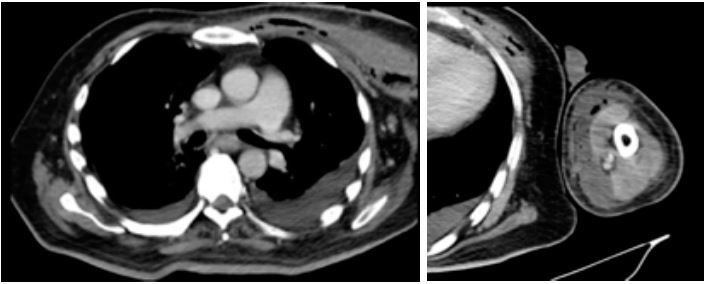
Figura 3. 3a y 3b. Día 4 de hospitalización - Día 19 de enfermedad.
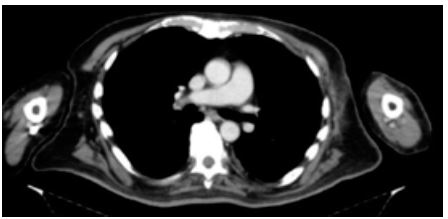
Figura 4. Día
30 de hospitalización - Día 45 de enfermedad.
En los días siguientes, el paciente tuvo
una lenta evolución favorable, menor dolor, menor edema, disminución progresiva
del volumen de drenaje, manteniendo características purulentas fétidas. Se
cultivó Streptococcus constellatus
de la secreción intraoperatoria del pectoral mayor izquierdo. Habiendo
completado 14 días de meropenem y vancomicina, de acuerdo con el antibiograma, se
pasó a ceftriaxona endovenosa. Se realizo tomografía de tórax control (Figura
4) evidenciando disminución significativa de la colección a nivel de pectoral y
axilar, y la presencia de densidades aéreas laminares. Concomitantemente, hubo
disminución progresiva de volumen en los drenajes, retirándose los drenes, primero
el esternal, luego el pectoral y por último el axilar izquierdo. Salió de alta
con disminución completa del edema en el miembro superior izquierdo, sin dolor,
con tratamiento antibiótico vía oral seguimiento ambulatorio.
DISCUSIÓN
La piomositis,
es la infección aguda del musculo estriado, relacionado con factores de riesgo
que condicionan inmunosupresión. Nuestro paciente tenía el antecedente de
diabetes mellitus insulino requiriente,
lo que lo hacía más propenso a piomiositis que
individuos no diabéticos. La diabetes mellitus puede propiciar daño muscular, lo
que eventualmente incrementa el riesgo de infarto, miositis y piomiositis. Adicionalmente, los pacientes con diabetes
mellitus son más susceptibles a microangiopatía lo que puede conllevar a
insuficiencia vascular y alteraciones de la migración de neutrófilos al
musculo. Asimismo, los pacientes con diabetes mellitus tienen un riesgo
incrementado de colonización por Staph. aureus.5, 6
En los estadios iniciales, cuando los
músculos afectados son profundos, la aponeurosis muscular y la fascia profunda
retardan transitoriamente el compromiso del tejido celular subcutáneo y la piel,
y los signos inflamatorios superficiales suelen estar ausentes. Se pueden distinguir
tres estadios. El primero, o estadio invasivo, se caracteriza por molestia
muscular, con leve edema, fiebre baja y decaimiento, sin presencia de
colección. Dado que sólo la aponeurosis se encuentra inervada, el dolor sobre
el músculo demora en aparecer entre una y dos semanas, luego se produce la
conformación del absceso. El segundo estadio, o purulento, es por la
conformación del absceso, comienza a ser sintomático con dolor severo, rigidez
muscular, edema moderado y fiebre; así, a la mayoría de los pacientes se los
reconoce en este momento evolutivo, el cual se desarrolla entre los 10 a 21
días de iniciado los síntomas. De no ser tratado, la enfermedad evoluciona a un
tercer estadio, el estadio de sepsis, donde presenta destrucción muscular,
extensión local con osteomielitis y septicemia. Se han descrito casos de
síndrome de choque tóxico debido a piomiositis.7,8
La presentación clínica de la piomiositis puede similar un cuadro de fasciítis
necrotizante e incluso pueden coexistir en pacientes inmunocomprometidos.9,10
Al
examen físico no se encuentran adenopatías regionales. Inicialmente no es
posible palpar el absceso dado que se encuentra en la profundidad del músculo,
pero el área se encuentra firme, asociada con dolor y rigidez.
En los exámenes de laboratorio puede
presentarse leucocitosis y eritrosedimentación elevada. Las concentraciones
plasmáticas de creatinafosfoquinasa, aldolasa y aspartato
aminotransferasa suelen ser normales a pesar de que se produzca una extensa necrosis
muscular, lo cual permite la exclusión de miositis de otras etiologías. Los hemocultivos
son positivos en 5% a 30% de los casos.11 El Streptococcus
constellatus es parte de la flora microbiana de la vía
aérea superior, puede aislarse en muestras de región faríngea, orofaríngea y
región gingival. También puede encontrarse en el tracto gastrointestinal y en
la región vaginal. Se le conoce por su facilidad para producir colecciones
purulentas en partes blandas, infecciones intraabdominales, infecciones
pulmonares, bacteriemia, infección del sistema nervioso central y endocarditis.
Los casos de bacteriemia normalmente son atribuidos a focos gastrointestinales
y/o del tracto respiratorio superior.12,13 Dentro de los estudios de imágenes
para el apoyo diagnóstico, la ecografía y la tomografía son los exámenes
iniciales para evaluar piomiositis y definir su
estadio. La ecografía permite detectar en forma inmediata los focos de
supuración intramusculares, evaluar el plano de la lesión y su dimensión. Su
utilidad es mayor en la etapa supurativa y como guía para la punción
diagnóstica y/o evacuatoria. Contribuye al diagnóstico diferencial con desgarros
musculares, celulitis, colecciones y fascitis. La tomografía computarizada
permite evaluar los planos de lesión y es útil para el estudio de los músculos
profundos. La resonancia magnética, es considerada el gold
standard, incluso en estadios iniciales, facilita la discriminación de los planos
fasciales y el diagnóstico diferencial con fasciítis
necrotizante. Su dificultad radica en el alto costo y baja accesibilidad.14
El tratamiento de la piomiositis dependerá del estadio en el que se encuentre.
En el estadio inicial, el tratamiento antibiótico es suficiente, debiendo
incluir una cobertura contra Staph. aureus. En los siguientes estadios, cuando el absceso ya
está conformado, está indicado el drenaje percutáneo o desbridamiento
quirúrgico asociado al tratamiento antibiótico de amplio espectro y será modificado
subsecuentemente en base a la sensibilidad antibiótica del germen aislado.15,16
La duración del tratamiento no se
encuentra establecida, generalmente se aplica durante tres a cuatro semanas,
con terapéutica endovenosa inicial, pero puede variar considerablemente de
acuerdo con la extensión de la enfermedad. El pronóstico es excelente, con la excepción
de los casos diagnosticados en estadios avanzados, que cursan con choque
séptico y fallo multiorgánico. La mortalidad varía entre 0,89% y 10% según diferentes
series, siendo la sepsis la principal causa de muerte.17-19
Nuestro paciente se presentó clínicamente
en un estadio 2, los exámenes de laboratorio descartaron miopatías y otras causas
de inmunosupresión. La tomografía de tórax ayudo a encaminar el diagnostico.
Sin embargo, si bien se inició cobertura antibiótica desde un inicio, dada la
extensión del compromiso, requirió cobertura antibiótica amplia, empírica e
ingreso a sala de operaciones para drenaje de la colección y colocación de
dren, cursando con mejora paulatina.
Hemos
querido dar a conocer este caso por lo infrecuente del diagnóstico, la localización
inusual de la piomiositis, el poco apoyo de los exámenes
auxiliares para el diagnóstico, por lo que se requiere la sospecha clínica y la
interpretación adecuada de los exámenes de imágenes, para con ello, identificar
el estadio de enfermedad y dar un tratamiento oportuno.
REFRENCIAS BIBLIOGRÁFICAS
1. Burdette SD, Watkins RR, Wong KK et al. Staphylococcus
aureus pyomyositis compared with non-Staphylococcus aureus pyomyositis. J Infect. 2012;64:507-12.
2. Chen WS, Wan YL. Iliacus pyomyositis mimicking septic arthritis of the hip joint. Arch Orthop Trauma Surg. 1996;115:233-5
3. Hall RL, Callghan JJ, Moloney E, Martínez
S, Harrelson J. Pyomyositis in a temperate climate. Presentation, diagnosis, and treatment. J Bone Joint Surg
Am. 1990; 72:1240-4.
4. Saeed K, Esposito S, Gould I, Ascione T, Bassetti M,
Bonnet E et al. Hot topics in necrotising
skin and soft tissue infections. Int J Antimicrob Agents. 2018;52:1-10.
5. Pozzilli P, Leslie R. Infections and diabetes:
mechanisms and prospects for prevention. Diabet Med. 1994;11:935-941.
6. Walling DM, Kaelin WG. Pyomyositis
in patients with diabetes
mellitus. Rev Infect Dis. 1991;13:797-802.
7. Villamil-Cajoto I, Maceriras-Pan
F, Villacián-Vicedo
M. Piomiositis: presentación de 17 casos en niños y adultos.
Rev Med Chile. 2006;134: 31-4.
8. Crum NF. Bacterial pyomyositis in the United States.
Am J Med.
2004;117: 420-8
9. Low DE, Norrby-Teglund A. Myositis, pyomyositis, and necrotizing fasciitis. Principles and Practice of Pediatric Infectious
Diseases. Elsevier, London,
2012, pp. 462-468.
10. Crum-Cianfl NF. Infectious myositis. Best Pract Res Clin Rheumatol. 2006;20:1083-96.
11. Stevens DL, Bisno AL, Chambers HF, Everett ED, Dellinger P, Goldstein EJ et al. Guidelines for skin and soft-tissue infections. Clin
Infect Dis. 2005;41:1373-406
12. Bickels J, Ben-Sira
L, Kessler A, Weintroub S. Primary pyomyositis. J Bone Joint Surg. 2002; 84-A: 2277-86.
13. Koneman. Color Atlas and Textbook of Diagnostic Microbiology.
2017;13:765-6.
14. Gordon BA, Martinez S, Collins AJ. Pyomyositis: characteristics at
CT and MR imaging. Radiology. 1995;197:279-86.
15. Hall RL, Callaghan JJ, Maloney E, Martinez S, Harrelson JM. Pyomyositis in a temperate climate. Presentation, diagnosis, and treatment. J Bone Jt Surg. 1990;72:1240-44.
16. Kwak YG, Choi SH, Kim T, Park
SY, Seo SH, Kim MB et al. Clinical guidelines for the antibiotic treatment for community-acquired skin and soft tissue infection. Infect Chemother. 2017;49:301-325.
17. Back SA, Fishbein G, Gwinup G. A case of group B streptococcal pyomyositis. Rev Infect Dis. 1990;12:784-7.
18. Adams EM, Gudmundsson S, Yocum DE, Haselby RC,
Craig WA, Sundstrom
WR. Streptococcal myositis.
Arch Intern Med. 1985; 145:1020-3
19. Consenso SADI-SAM-SAD-CACCVE. Guía para el manejo racional de
las infecciones de piel y partes blandas. Rev Panam Infectol.
2009; 11: 50-5.
CORRESPONDENCIA:
Enrique
Otoya enrique.otoya.d@gmail.com
Fecha
de recepción: 04-09-2021. Fecha de aceptación: 02-11-2021. Fuente de
financiamiento: por el autor.
Conflictos
de interés: ninguno, según declaración del autor.
Como citar:
Otoya E. Piomiositis
en un adulto con diabetes mellitus. Rev Soc Peru Med
Interna. 2021;34(4):177-180. DOI: https://doi.org/10.36393/ spmi.v34i4.634