Reporte
de caso
Miocardiopatía
por amiloidosis: una causa imprevista de accidente cerebrovascular
Amyloidosis cardiomyopathy:
an unforeseen cause of stroke
Marco
Lazo-Soldevilla
Asistente
del Servicio de Cardiología. Hospital Nacional Ramiro Prialé Prialé, Huancayo, Junín, Perú.
Lizeth
Meza- Centeno
Estudiante
de medicina. Facultad de Medicina Humana, Universidad Nacional del Centro de Perú,
Huancayo, Junín, Perú.
Carmen
Santos-Julca3,
Asistente
del Servicio de Hematología Hospital Nacional Ramiro Prialé Prialé,
Huancayo, Junín, Perú.
Richard
Maita-Hinostroza
Asistente
del Servicio de Patología. Hospital Nacional Ramiro Prialé Prialé,
Huancayo, Junín, Perú.
RESUMEN
Varón de 57 años de edad, con
antecedente de neuropatía periférica y disnea a medianos esfuerzos de un año de
evolución, ingresó por cuadro de accidente cerebrovascular isquémico. Los
estudios electrocardiográficos y ecocardiográficos revelaron una miocardiopatía
hipertrófica subyacente. El proteinograma electroforético.y
la inmunofijación mostraron que se trataba de una gammapatía
monoclonal por cadenas ligeras tipo lambda. La biopsia de mucosa gingival y médula
ósea demostraron la presencia de amiloidosis. Se concluyó en que se trataba de
una amiloidosis cardiaca de cadenas ligeras secundaria a gammapatía
monoclonal de significado incierto GMUS. El paciente recibió quimioterapia pero
falleció a los dos meses de su ingreso.
Palabras claves: accidente cerebrovascular
isquémico, miocardiopatía infiltrativa, amiloidosiscardiaca,
cadenas ligeras, GMUS.
ABSTRACT
A 57-year-old male with
a history of peripheral neuropathy and dyspnea for one
year of evolution
was admitted for ischemic stroke.
Electrocardiographic and ultrasound
studies revealed underlying hypertrophic cardiomyopathy.The electrophoretic
proteinogram and immunofixation
showed that it was a monoclonal gammopathy by lambda-light chains. Biopsy of gingival mucosa demonstrated and
bone marrow the presence of
amyloidosis. It was concluded that it was a cardiac
of light chains amyloidosis secondary to monoclonal gammopathy of uncertain significance
GMUS.The patient received chemotherapy but died two
months after admission.
Keywords: ischemic stroke, infiltrative cardiomyopathy, cardiac amyloidosis, light chains, GMUS.
INTRODUCCIÓN
La amiloidosis cardiaca es una
miocardiopatía infiltrativa que se caracteriza por el depósito extracelular de proteínas
fibrilares insolubles a nivel miocárdico generando insuficiencia cardiaca con
una progresión rápida y una mortalidad mayor del 50% sin un diagnóstico
oportuno, siendo la amiloidosis de cadenas ligeras la más frecuente y la de
peor pronóstico.
PRESENTACIÓN DEL CASO
Paciente varón de 57 años de edad,
nacido en Perú, con antecedente de neuropatía periférica y disnea a medianos
esfuerzos de un año de evolución, ingresó al
hospital por un cuadro de accidente cerebrovascular isquémico. Al examen
físico: PA 90/60 mm Hg, frecuencia cardiaca 80 por minuto; despierto, obedece
ordenes, Glasgow 15. Presenta equimosis periorbitaria
bilateral, ingurgitación yugular, ascitis, edema de miembros inferiores, y al examen
cardiovascular ruidos cardiacos rítmicos, soplo sistólico 2/6 foco mitral; y, con
hemiplejia izquierda.
El electrocardiograma mostró complejos
de bajo voltaje en derivaciones inferiores y precordiales (Figura 1).
La ecocardiografía transtorácica reveló
un miocardio de aspecto granular
e hipertrófico a nivel del ventrículo izquierdo (VI), ventrículo derecho (VD), septum
interatrial y válvulas auriculoventriculares (Figuras
2-4), dilatación biauricular, hipocinesia global, disfunción sistólica moderada
FEVI 38%, disfunción diastólica grado III (figura 5) y derrame pericárdico laminar;
Strain Rate del VI en -4
con afección basal y medial, sin compromiso apical (Figuras 6 y 7).

Figura 1. ECG: ritmo sinusal, complejos de voltaje (QRS <0,5 mV) en derivaciones inferiores y mala progresión de onda R
de V1 a V6.
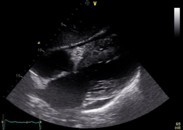
Figura 2. Eje largo: engrosamiento del septum interventricular y pared posterior
del VI, asociado a derrame pericárdico laminar.

Figura 3. Cuatro cámaras: miocardio de aspecto granular (patrón en sparkling), engrosamiento de la pared del ventrículo
izquierdo y derecho, septum interauricular y válvulas A-V. Dilatación
biauricular y derrame pericárdico laminar.

Figura 4. Vista subxifoidea: Aumento del espesor
del septum interventricular

Figura 5. Patrón de relajación del VI: patrón restrictivo – disfunción diastólica
del VI severa (grado 3).

Figura 6. Strain Rate: las
imágenes de deformación muestran el patrón de reducción del Strain
en segmentos basales y medios, sin compromiso apical.

Figura 7. Ojo de buey: Marcada afectación basal y medial y relativa
preservación apical, Strain longitudinal en -4.
La cardiorresonancia
a nivel morfológico mostró el aumento global del espesor de las paredes del VI,
VD, valvular y septum interatrial (Figura 8).
 El SPECT cardiaco con 99mTc-pirofosfato
presentó una distribución del radiofármaco a nivel de las estructuras óseas con
captación mínima a nivel de la silueta cardiaca (Figura 9) disociación del
cociente albumino - globulina con predominio de cadenas ligeras (figura 10).
El SPECT cardiaco con 99mTc-pirofosfato
presentó una distribución del radiofármaco a nivel de las estructuras óseas con
captación mínima a nivel de la silueta cardiaca (Figura 9) disociación del
cociente albumino - globulina con predominio de cadenas ligeras (figura 10).
La inmunofijación muestra un
predominio de bandas en cadena ligera lambda y la biopsia de medula ósea el depósito
de material amiloide a nivel peritrabecular con plasmocitosis medular en 6%, concluyéndose en amiloidosis
cardiaca de cadenas ligeras (AL) secundaria a gammapatía
monoclonal de significado incierto (GMUS) (Figura 10), por lo que se inició
tratamiento quimioterápico con dexametasona, talidomida y ciclofosfamida; anticoagulación
y terapia de insuficiencia cardiaca. La evolución fue tórpida, falleciendo el
paciente a los dos meses posteriores a su admisión.

Figura 8. Resonancia magnética cardiaca: Aumento global del espesor de las cavidades
cardiacas y septum
interauricular; dilatación
biauricular y derrame pericárdico.

Figura 9. SPECT cardiaco con 99Tc-pirofosfato: Distribución del
radiofármaco a nivel de estructuras óseas con captación mínima a nivel
cardiaco, sugerente de amiloidosis de cadenas ligeras.
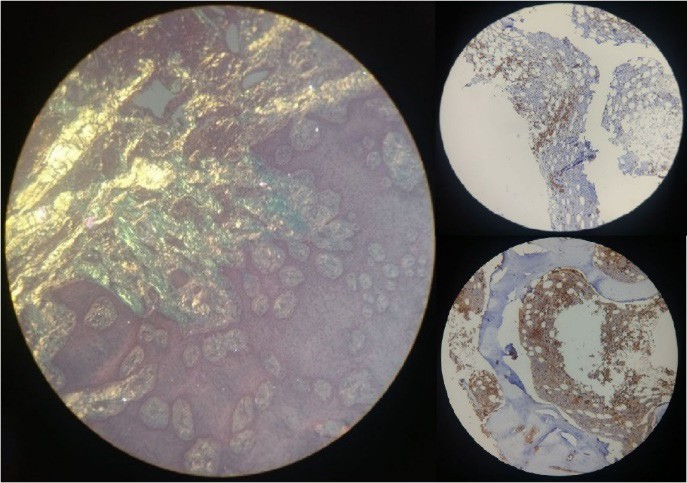
Figura 10. Biopsia de encía y medular con inmunohistoquímica: a. Biopsia
de encía con Tinción Rojo Congo positivo para depósito de amiloide. b. Tinción
de inmunohistoquímica CD138 de medula ósea: infiltrado por células plasmáticas.
c. Tinción de inmunohistoquímica lambda indicativo de monoclonalidad
de cadenas ligeras.
DISCUSIÓN
La amiloidosis cardiaca es una
miocardiopatía infiltrativa poco frecuente con una incidencia de 3 a 12 casos
por millón de personas al año, caracterizada por el aumento del grosor de la
pared del ventrículo izquierdo debido al depósito extracelular de proteínas fibrilares
insolubles a nivel miocárdico, Existen dos tipos principales de
amiloidosis cardiaca, el tipo transtiretina (TTR) y
el de cadenas ligeras (AL), siendo esta última la más frecuente y de peor
pronóstico, la cual es secundaria a la presencia de células plasmáticas monoclonales
que producen un exceso de cadenas ligeras a predominio de tipo lambda; la edad media
de presentación es de 50 años siendo más frecuente en varones.1
La manifestación clínica más frecuente
es la insuficiencia cardiaca congestiva asociado a una mortalidad mayor del
50% a los seis meses del diagnóstico y de no recibir tratamiento. El diagnóstico
se basa en la sospecha clínica, electrocardiograma, estudios por imagen y la
biopsia confirmatoria de la enfermedad.1
Los hallazgos
electrocardiográficos
característicos son la presencia de complejos QRS de bajo voltaje
con una amplitud <1 mV en derivaciones precordiales
o <0,5 mV en derivaciones de miembros y un patrón de
pseudoinfarto con mala progresión de la onda R en las
derivadas precordiales; tal como se encontró en el caso.2
La ecocardiografía es uno de los pilares
fundamentales en el diagnóstico; así, James White et al, en Current
Cardiology Reports 2016, describieronn los siguientes hallazgos: aumento en el
espesor de la pared del VI de aspecto granular (patrón Sparkling),
del VD, septum interatrial y a nivel valvular;
fracción de eyección normal o ligeramente disminuida, disfunción diastólica
progresiva y alteración del Strain longitudinal
comprometiendo los segmentos basales y mediales de todas las paredes,
respetando los segmentos apicales. La dilatación biauricular, disfunción
diastólica grado III y derrame pericárdico son indicadores de amiloidosis
cardiaca en fase avanzada, definido como tal en el reporte.3
La disfunción de la aurícula izquierda
caracterizada por una onda a pequeña, disminución de la fracción de eyección y
del Strain auricular condiciona episodios trombo- embólicos,
incluso en el contexto de ritmo sinusal.1
La resonancia magnética cardiaca en la
amiloidosis permite la evaluación morfológica, funcional y la caracterización tisular
del miocardio; identificando el depósito focal de gadolinio, prolongación del
tiempo T1 (precontraste) y aumento del volumen extracelular
secundario al depósito de proteína amiloide; con una sensibilidad del 87%. El patrón
típico de la amiloidosis es la presencia del depósito difuso de gadolinio a
nivel subendocárdico con compromiso global de todas las paredes del VI, VD, a
nivel valvular y del septum interatrial.4
El estudio se complementa con SPECT cardiaco
con 99mTc - pirofosfato a fin de diferenciar los dos tipos principales de
amiloidosis cardiaca, para lo cual se utiliza la escala visual y
semicuantitativa, siendo esta mayor de 1,5 criterio para TTR, que en el reporte
fue negativo y, or ende, sugerente de amiloidosis AL.3
La confirmación diagnóstica requiere
del estudio histológico a través de
la biopsia endomiocárdica,
grasa subcutánea abdominal, rectal, encía o de médula ósea, utilizando la
tinción rojo Congo que muestra la hiperrefringencia
color verde en el estudio microscópico.2 Así mismo, para diferenciar el tipo de
amiloide se requiere del proteinograma electroforético en sangre, que determina
la presencia de proteínas de cadena ligera, existiendo dos tipos: kappa y
lambda, siendo esta última la de mayor frecuencia determinada a través de la inmunofijación.5
El aspirado y biopsia de medula ósea definen
la etiología de amiloidosis AL, siendo el criterio diagnóstico para mieloma
múltiple la presencia de células plasmáticas mayor al 10%, y de ser menor es catalogado
como gammapatía monoclonal de significado incierto (GMUS).2
En el reporte de caso presentado, se
realizó biopsia de encía y de medula ósea, proteinograma electroforético e
inmunohistoquímica, con resultados compatibles con amiloidosis cardiaca de
cadenas ligeras a predominio lambda secundario a GMUS.
El
tratamiento se basa
en el manejo
convencional de la
insuficiencia cardiaca, reducción de
cadenas ligeras amiloidógenas con
el uso de
quimioterápicos y anticoagulación como prevención de eventos
tromboembólicos.5
Los diagnósticos diferenciales
principales se establecen con la miocardiopatía hipertrófica y con la
enfermedad de Fabry. En la miocardiopatía hipertrófica, la ecocardiografía
muestra incremento del grosor del VI
sin compromiso de las válvulas
auriculoventriculares ni del septum interatrial. La
disociación entre la fracción de eyección con el Strain
longitudinal global de acuerdo a un índice > 4,1 es característico de la
amiloidosis cardiaca. En la enfermedad de Fabry, la ecocardiografía presenta un
aumento del espesor del ventrículo
izquierdo, derecho y de los
músculos papilares, con una apariencia binaria del borde subendocárdico; el
aumento absoluto del área de los músculos papilares, así como de la relación
entre esta y el área ventricular izquierda en eje corto, tienen una sensibilidad del 75% y especificidad del
86% para esta entidad; y, la cardiorresonancia
muestra el depósito focal de gadolinio mesial en el segmento basal de la pared
inferolateral y a nivel de la pared auricular, asociado a un acortamiento del tiempo T1 nativo, a
diferencia de la amiloidosis cardiaca en el que se encuentra incrementado. En conclusión,
el caso reportado resalta la importancia del uso de técnicas de imagen para el
diagnóstico oportuno y precoz de una miocardiopatía infiltrativa poco
frecuente, con el fin de brindar un tratamiento óptimo y mejorar la tasa de
sobrevida en estos pacientes.
REFERENCIAS
BIBLIOGRÁFICAS
1. Falk RH, Alexander KM, Liao R, Dorbala S. AL (Light-Chain) Cardiac Amyloidosis: A Review of Diagnosis and Therapy. J Am Coll Cardiol.
2016 September 20;
68(12):1323-1341.
2. Murtagh B, Hammill SC, Gertz MA, Kyle RA, Tajik AJ, Grogan M. Electrocardiographic
findings in primary systemic amyloidosis and biopsy-proven cardiac involvement. Am J Cardiol. 2005 Feb 15;95(4):535-7. doi: 10.1016/j.amjcard.2004.10.028. PMID:
15695149.
3. White JA, Fine NM. Recent Advances in Cardiovascular Imaging
Relevant to the Management of Patients with Suspected
Cardiac Amyloidosis. Curr Cardiol Rep.
2016 Aug;18(8):77. doi: 10.1007/ s11886-016-0752-7.
PMID: 27319007.
4. Bhatti S, Watts E, Syed F, Vallurupalli
S, Pandey T, Jambekar
K, et al. Clinical and prognostic
utility of cardiovascular magnetic resonance imaging in myeloma patients with suspected
cardiac amyloidosis. European Heart Journal -
Cardiovascular Imaging. 2016 September
17; 17 (9):970-977.
5. Cibeira T & Bladé J. Amiloidosis
primaria: diagnóstico, pronóstico y
tratamiento. Haematologica/edición española.
2011; 96(4), 13-18.
Citar
como
Lazo-Soldevilla
M, Meza-Centeno L, Santos-Julca C, Maita-Hinostroza
R.
Miocardiopatía por amiloidosis: una causa imprevista de accidente
cerebrovascular. Rev Soc Peru Med Interna. 2022;35(1):
37-40. https://doi.org/10.36393/spmi.v35i1.655
CORRESPONDENCIA
Lizeth
Meza-Centeno lizethkmc@hotmail.com
Fecha
de recepción: 17-01-2022
Fecha
de aceptación: 28-02-2022.
Fuentes
de financiamiento: por los autores.
Conflictos
de interés: ninguno, según los autores.
CONTRIBUCIÓN
DE LOS AUTORES: MLS concibió la idea del trabajo. MLS, CSJ y RMH participaron
en la recolección de la información, discusión y redacción del texto y aprobación
final del mismo. LMC participó en la búsqueda bibliográfica.









